 Receptores proteicos G
Receptores proteicos G
Versión para impresión
[ Principal ] [ Arriba ] [ Célula Eucariota: generalidades ] [ Célula Eucariota: núcleo ] [ Membrana celular ] [ Citoplasma ] [ Orgánulos ] [ Regulación del Ciclo Celular ] [ Transporte ] [ Ciclo celular ] [ Mitosis ] [ Meiosis ] [ Receptores ] [ Receptores G ]
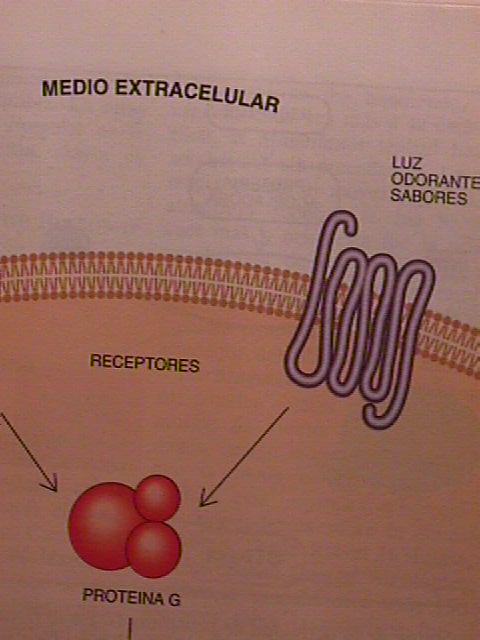
El cuerpo usa receptores "serpiente" que atraviesan
7 veces la membrana en una sorprendente variedad de señales
biológicas.
Receptores en nuestra lengua nos permiten apreciar el gusto.
Cientos de diferentes receptores de las células de nuestro
tracto olfativo nos dan información de los olores.
Una molécula de carotenoide, relacionada con la vitamina A,
se pega en la posición ligando de la rodopsina, en los conos y
bastones de nuestros ojos, donde detectan fotones, alteran su
configuración y causan que el receptor al cual están ligados
mande señales al citoplasma del cono o bastón que resulta en
nuestra percepción de la luz.
Estos receptores "serpiente" son de aparición muy
antigua en la evolución. Las levaduras comunican su identidad
sexual por medio de un polipéptido que actúa como factor de
encuentro. Los receptores celulares que reconocen estos factores
de encuentro son receptores "serpiente" que atraviesan
7 veces la membrana.
Un buen ejemplo de estos, es el muy estudiado receptor de la
epinefrina.
Epinefrina
El ligando epinefrina, también conocido como adrenalina
es liberado por la medula de las glándulas adrenales, que se
encuentran encima de los riñones, por una gran variedad de
estímulos "estresantes". Una vez liberada al torrente
sanguíneo se liga a receptores específicos de la superficie
celular en diversos tejidos del cuerpo. El resultado es el
establecimiento de la primitiva reacción de alerta / huida
.
Esta reacción incrementa el latido cardíaco, decrece el
flujo sanguíneo al intestino, lo incrementa a los músculos esqueléticos, e incrementa los niveles de glucosa al causar que
las células musculares y hepáticas desdoblen el glucógeno
(forma de reserva de la glucosa) y liberen glucosa a la sangre.
¿Cómo produce la adrenalina estas respuesta? Actuando como
ligando, se pega a los receptores específicos que se encuentran
expuestos en la superficie de un gran numero de células del
organismo. Este receptor , llamado beta-adrenergico, es un
receptor tipo "serpiente" que se encuentra embebido en
la membranas plasmática de estas células (la atraviesa 7
veces).
Como en el caso de los factores de crecimiento ya descriptos,
la adrenalina no penetra en la célula, en vez de ello,
uniéndose por un corto periodo de tiempo a su receptor, lo
induce a liberar señales bioquímicas al citoplasma de las
células.
Los receptores "serpiente", como el receptor beta
adrenérgico no dependen de la dimerización del receptor para
transducir la señal. En vez de ello, una molécula de receptor cambia su
configuración estérica en respuesta al "pegado" del
ligando. Este cambio estérico afecta la configuración del
dominio citoplasmático de la proteína, esto es el
"lazo" del receptor que protruye en el citoplasma.
Transducción de la señal
El receptor beta adrenérgico se comunica con el citoplasma
estimulando una segunda proteína que se conoce como proteína G
por razones que enseguida se entenderán. La proteína G
generalmente se encuentra cerca del receptor en forma inactiva.
Cuando el receptor es activado por un ligando , rápidamente
actúa sobre la proteína G.
La proteína G responde rápidamente activándose a si misma
y, ya en el estado activo, envía señales a otras moléculas del
citoplasma celular. Sin embargo la proteína G solo permanecerá
en estado activo por un breve periodo pasándose luego a la forma
inactiva.
En efecto, la proteína G actúa como una llave binaria
autoapagable (equivalente a una llave de luz autoapagable como
las que se encuentran en muchos edificios ), que cuando esta
"on" permanece así un pequeño periodo de tiempo hasta
que se pone asimismo en "off".
Los dos estados (encendido/apagado) están determinados por el
nucleótido de guanina que se encuentra pegado a ella (de allí
el nombre de proteína G).
Cuando esta inactiva pega GDP (guanosín difosfato),
cuando esta activa GTP (guanosín trifosfato) En
consecuencia, la forma inactiva ("apagada") de la
proteína G se presenta cuando la misma tiene ligado GDP.
Cuando el ligando se "pega" a ella, libera GDP y
permite que el GTP se una. Esta forma de la proteína G que liga
GTP, es la forma activada ("encendida") de la misma
Cuando esta "encendida" libera señales al interior de
la célula. Luego de un corto periodo (segundos o menos) la
proteína G hidroliza el GTP a GDP y se "apaga" asimisma.
Esta hidrólisis representa un mecanismo de retroalimentación
negativo que asegura que la proteína G solo estará activa por
un corto tiempo.
EFECTO CASCADA
Se describirá brevemente el flujo de la señal (a menudo
nombrado como efecto cascada) que es disparado por la proteína G
activa. La proteína G esta formada por tres subunidades
proteicas llamadas alfa, beta y gamma. En su forma inactiva las
tres subunidades se encuentran unidas. La subunidad alfa es la
que tiene el GDP. Cuando el receptor beta adrenérgico activa la
proteína G, la subunidad alfa libera el GDP, pega GTP y luego se
separa de las subunidades beta y gamma.
Cuando esto ocurre la subunidad alfa pierde su afinidad por el
receptor, se disocia de el, y se mueve hacia otra proteína
cercana, la enzima adenilato ciclasa, que hasta el momento estaba
inactiva y que ahora es activada y comienza su trabajo: convertir
el ATP en 3'5' AMP cíclico. Esta reacción implica liberar los
fosfatos gamma y beta del ATP ligar el fosfato restante (que esta
esterificando a la ribosa en la posición 5') al hidroxilo 3'
formando una estructura cíclica conocida como "AMP
cíclico" o simplemente AMPc.
Luego de varios segundos de la unión con la adenil-ciclasa,
la subunidad alfa de la proteína G hidroliza el GTP , abandona
la adenilato ciclasa y se pone en "off" (apagado) y
retorna a su unión con las subunidades beta y gamma (lugar de
donde había "desertado" al comienzo del
"juego"). La adenil ciclasa se torna inactiva y deja de
producir AMPc. Todo este ciclo origina un breve "pulso" de señales
que producen, en este caso, unos cientos de moléculas de AMPc.
El AMPc actúa como un segundo mensajero que
difunde por el citoplasma (el primer mensajero es el
ligando en la superficie celular, estos ligandos son en general
productos conocidos como hormonas: por ejemplo la
epinefrina) llevando su acción al mismo. En ausencia de eventos
como el señalado anteriormente, el nivel de AMPc en muy bajo, se
eleva como consecuencia de este proceso y, como puede Ud.
imaginarse, es rápidamente hidrolizado a AMP (no cíclico) con
lo cual el estimulo termina.
En varios sitios de la célula el AMPc se pega a otra enzima
una serina /treonina proteina-kinasa, llamada la AMPc-kinasa
dependiente o simplemente ''A kinasa''. La A kinasa, una
vez activada , puede fosforilar específicamente determinadas
proteínas , específicamente en sus residuos serina/treonina, y
al hacerlo las activa. En el caso de las células del hígado que
almacenan grandes cantidades de glucógeno , el AMPc hace que la
A-kinasa se active y
- fosforile y por lo tanto active una enzima que activa la glucogeno-fosforilasa,
que a su turno rompe el glucógeno en moléculas de
glucosa-1-fosfato; y
- fosforila la glucógeno sintetasa, y de esta
manera haciendo que la misma no trabaje, e impidiendo la
reconversión del glucosa en glucógeno. Estos dos
cambios (activación de la enzima que degrada, e
inhibición de la enzima que sintetiza) aseguran la
movilización del glucógeno almacenado en el hígado a
glucosa. Otras reacciones son activadas de manera similar en otras
células para contribuir a la respuesta de alerta / huida del organismo.
Esta "cascada " de reacciones aumenta enormemente la
señal que llego a la célula. Una molécula de epinefrina causa la activación de la subunidad
alfa del receptor, ella activara a una adenilato-ciclasa, la cual
a su vez sintetizara cientos de AMPc. Cada uno de los AMPc puede
activar una kinasa- AMPc - dependiente, que a su vez puede
modificar cientos de moléculas en la célula..
Otros casos:
1. Otro mecanismo de
amplificación es el implicado en el fenómeno de erección del
pene, los científicos determinaron que en este caso el ligando
es el NO (oxido
nítrico), que es el principal neurotransmisor en el
pene .