|
|
ATAQUE A LA MEMBRANA VITELINA POR LOS ESPERMATOZOIDESContenidos
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fig. 11 | |
|---|---|
| Acción de la lisina sobre la membrana vitelina | |
 |
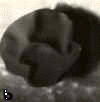 |
| a: ovocito degangado de Bufo arenarum | b: el mismo ovocito
que en a luego de 10 minutos de acción de la lisina |
 |
|
| c: a la
izquierda, el mismo ovocito luego de aproximadamente 3 horas de acción
de la lisina. A la derecha un ovocito no atacado. MV: membrana vitelina; PA: polo animal; PV: polo vegetativo. |
|
Luego de una hora, la membrana aparece engrosada y el ataque sobre ella prosigue hasta que, finalmente ya no es posible visualizarla (Fig. 11: c). Sí se agrega tinta china al medios se puede observar alrededor de los ovocitos un halo claro, resultante de la presencia del material proveniente de la lisis de la membrana vitelina. Existe una correlación entre la concentración de espermatozoides y la actividad lítica. En nuestras condiciones de trabajo, se requieren alrededor de 1.106 espermatozoides por mililitro para conseguir este efecto (Tabla 14 ).
| TABLA 13 | |||
| Actividad lítica de las suspensiones de espermatozoides sobre ovocitos degangados | |||
|---|---|---|---|
| Experimento | Agregado al medio | Efecto lítico en degangados con KCN | Efecto lítico en degangados con tioglicólico |
| 1 |
Espermatozoides |
+ | + |
|
Ringer 0,1 |
- | - | |
| 2 |
Espermatozoides |
+ | + |
|
Ringer 0,1 |
- | - | |
| 3 |
Espermatozoides |
+ | + |
|
Ringer 0,1 |
- | - | |
|
|
|||
Es necesario aclarar que, en estas condiciones, la adición de espermatozoides a los ovocitos degangados no da lugar a la fecundación no observándose tampoco signos exteriores de activación, como ser la aparición del segundo polocito.
|
Actividad lítica y concentración de los espermatozoides |
|
|---|---|
| Concentración de espermatozoides |
Efecto lítico |
| 1,9 . 107 | ++ |
| 6,2 . 106 | ++ |
| 2,4. 106 | ++ |
| 1,4.106 | + |
| 3,9.105 | - |
| - | - |
|
La Tabla indica en cruces el valor relativo del efecto lítico observado luego del agregado de la suspensión de espermatozoides a ovocitos degangados con KCN. Los controles se mantuvieron en Ringer 0,1 Otros detalles ver en Tabla 13. |
|
Un punto muy importante de destacar es que la membrana vitelina de los ovocitos activados (o sea la membrana de fecundación ) no resulta atacada por los espermatozoides, tal como se observa en la Tabla 15 la membrana de los ovocitos de Bufo arenarum activado, por picadura con una aguja de vidrio, no son sensibles al ataque de las suspensiones de espermatozoides.
| TABLA 15 | ||
| Efectos de la activación sobre la acción lítica de los espermatozoides | ||
|---|---|---|
| Experimento |
Efecto lítico sobre ovocitos no activados |
Efecto lítico sobre ovocitos activados |
| 1 | + | - |
| 2 | + | - |
| 3 | + | - |
|
Se utilizaron ovocitos degangados con KCN. Grupos de alrededor de 50 ovocitos se activaron y se pusieron en presencia de suspensiones de espermatozoides (5.10 6 esp. / ml). Los resultados se expresan como en la Tabla 13 |
||
Dado que en Bufo arenarum la activación del ovocito implica la ruptura de los gránulos corticales, es probable que este fenómeno este vinculado al cambio de susceptibilidad de la membrana frente a las lisinas espermáticas. Este cambio convertiría a la membrana vitelina en una barrera contra la polispermia, esto no excluye, por supuesto, que los cambios producidos a nivel de corteza puedan coadyuvar en este sentido.
Coincidentemente con nuestros resultados en Rana temporaria se observó que la membrana vitelina de los ovocitos activados se torna resistente al ataque por la tripsina y al tratamiento con ácido tioglicólico
(![]() ).
).
La lisis de la membrana vitelina no requiere la presencia de los espermatozoides. En efecto, el producto responsable de la lisis se libera al medio de incubación, ya que los sobrenadantes de 20.000 g de suspensiones de espermatozoides producen el mismo efecto sobre el ovocito que la presencia de los espermatozoides (Fig. 11, Tabla 16). Si relacionamos este hecho con las imágenes de la reacción acrosómica anteriormente descritas es de suponer que el producto que se detecta en los sobrenadantes corresponde al liberado por los espermatozoides durante la reacción acrosómica espontánea
| TABLA 16 | ||
| EFECTO LÍTICO DE LOS SOBRENADANTES DE ESPERMATOZOIDES | ||
|---|---|---|
| Experimento |
Efecto lítico del sobrenadante |
Ringer 0,1 |
| 1 | + | - |
| 2 | + | - |
| 3 | + | - |
|
El sobrenadante se obtuvo por centrifugación a 20.000 g durante 30 minutos (a 4 °C) de una suspensión de espermatozoides (20.10 6 esp. / ml) previamente incubada a 20 °C durante 6 horas en Ringer 0,1.. Los resultados se expresan como en la Tabla 13 |
||
Dado que las suspensiones de espermatozoides fueron preparadas por homogeneización de testículos, fue necesario establecer si el producto responsable de la lisis estaba ligado a los espermatozoides o bien a otras estructuras celulares. Basados en el hecho que la lisina no se libera cuando la suspensión de espermatozoides se mantiene en fríos se desarrolló el esquema de la Tabla 17 . El mismo demuestra que la actividad está asociada a la presencia de los espermatozoides.
| TABLA 17 |
| Demostración experimental de la asociación del efecto lítico con
los espermatozoides. La actividad fue ensayada sobre ovocitos degangados con KCN. |
Por otra partes si se eliminan los restos celulares que contaminan a las suspensiones de espermatozoides, por medio de centrifugación y lavado repetidos y luego se liofilizan los espermatozoides, cuando se resuspenden los mismos, los acrosomas aparecen rotos y la actividad lítica se detecta en la fase soluble.
Reacciones cruzadas entre ovocitos de Bufo arenarum y suspensiones de espermatozoides de otras especies de anfibios, mostraron la presencia de actividad lítica en la mayoría de los ensayos (Tabla 18). Se encontró que las suspensiones de espermatozoides de Bufo paracnemis , Leptodactylus bufonious , Leptodactylus chaquensis y Leptodactylus prognathus disuelven la membrana vitelina de los ovocitos de Bufo arenarum . Solo Phyllomedusa sauvagii , especie que se encuentra taxonómicamente alejada del genero Bufo, no presenta actividad lítica, pero su fecundación es de un tipo especial ya que ocurre fuera del agua. Esta experiencia demuestra únicamente la existencia de productos líticos en las suspensiones de otras especies de anfibios, lo que no implica necesariamente que los productos sean los mismos. En efecto, si se prueban extractos crudos de Leptodactylus chaquensis sobre
![]() es posible detectar actividad proteolítica mientras que esto no sucede con los obtenidos a partir de los espermatozoides de Bufo arenarum.
es posible detectar actividad proteolítica mientras que esto no sucede con los obtenidos a partir de los espermatozoides de Bufo arenarum.
| TABLA 18 | |
|
Efectos de las suspensiones de espermatozoides de diferentes especies de anuros sobre la membrana vitelina de los ovocitos de Bufo arenarum |
|
|---|---|
|
Origen de los espermatozoides |
Efecto lítico |
|
Bufo arenarum |
+ |
| Leptodactylus bufonius | + |
| Leptodactylus chaquensis | + |
| Leptodactylus prognatus | + |
| Phyllomedusa sauvagii | - |
|
Las diferentes suspensiones se pusieron en contacto con muestras de alrededor de 50 ovocitos de Bufo arenarum degangados con KCN. Los resultados se indica como en la tabla 13. |
|
Cuando se adicionan inhibidores de proteinasas al medio en el que se ensayan los extractos crudos de lisina de
Bufo arenarum, se observa que los mismos inhiben en diferente grado el efecto lítico
(Tabla 19). En este ensayo los inhibidores se encuentran en concentración suficientes para bloquear la actividad de la tripsina según puede observarse en la misma Tabla.
En estas condiciones el mayor efecto inhibidor corresponde al ![]() , el
Ovomucoide no presenta inhibición y el
, el
Ovomucoide no presenta inhibición y el ![]() un efecto intermedio.
un efecto intermedio.
| Tabla 19 | |||||
Inhibidores de proteinasas y lisis de la membrana vitelina |
|||||
|---|---|---|---|---|---|
| Enzima/s | Inhibidor | Efecto lítico | |||
|
|
30 seg | 3 min | 10 min. | 30 min. | |
| Ovomucoide (2 mg / ml) | + | ++ | ++++ | ||
| - | + | ++ | |||
|
|
- | - | - | ||
| -- | + | ++ | +++ | ||
|
Tripsina (0,15mg/ml) |
Ovomucoide (2 mg / ml) | - | - | - | - |
| - | - | - | - | ||
| |
- | - | - | - | |
| -- | + | ++ | ++++ | ++++ | |
|
Ovocitos de Bufo arenarum degangados con KCN se trataron con extractos crudos de lisina homóloga y con tripsina en presencia de inhibidores de proteinasas. Los paréntesis indican las .concentraciones finales de enzimas e inhibidores |
|||||
La actividad lítica es sensible a la acción del calor y el producto activo precipita por el agregado de sulfato de amonio al 60 - 70 %. El precipitado da reacción positiva cuando se lo ensaya con los reactivos de Biuret, azul de bromofenól y nigrosina para proteínas
(![]() ).
).
Cuando se corre extractos crudos de lisina en una columna de Sephadex G-200, la actividad se detecta con el volumen excluido, lo que indica que posee un peso molecular aparente mayor de 200.000
(Fig. 12).
El producto activo se pega en ® DEAE - Sephadex y se eluye con NaCl alrededor de 120 mM
(Fig. 13), la actividad lítica eluída es sensible al
![]() y en menor grado al
y en menor grado al
![]() , su actividad no es afectada por el
Ovomucoide
, su actividad no es afectada por el
Ovomucoide
Las lectinas (![]() ,
,
![]() ) son un grupo de substancias, la mayor parte de ellas de origen vegetal, que presentan una serie de propiedades biológicas y químicas muy interesantes. Aglutinan eritrocitos, "ligan" azúcares específicamente y precipitan polisacáridos y glicoproteínas también de manera específica. Algunas de ellas son mitogénicas . Actualmente son muy utilizadas para investigar la arquitectura de las superficies celulares y los cambios que se producen en las células malignas. También son utilizadas para aislar constituyentes específicos de membranas.
) son un grupo de substancias, la mayor parte de ellas de origen vegetal, que presentan una serie de propiedades biológicas y químicas muy interesantes. Aglutinan eritrocitos, "ligan" azúcares específicamente y precipitan polisacáridos y glicoproteínas también de manera específica. Algunas de ellas son mitogénicas . Actualmente son muy utilizadas para investigar la arquitectura de las superficies celulares y los cambios que se producen en las células malignas. También son utilizadas para aislar constituyentes específicos de membranas.
Recientemente se introdujo el uso de lectinas para estudiar algunos aspectos de la relación ovocito-espermatozoide en diversas especies
(![]() ,
,
![]() ,
,
![]() ).
).
Cuando se pretratan ovocitos sin ganga de Bufo arenarum con concanavalina A ( lectina que se extrae de la
Canavalia ensiforme ) y se los somete a la acción de las proteinasas acrosómicas, las mismas no afectan la membrana vitelina del ovocito (
Tabla 20 ). Este efecto es revertido por acción de
alfa-metil-D-manósido , alfa-D-glucósido y membranas vitelinas sonicadas
(Tabla 21).
| Tabla 20 | |
|
Efecto de la Concanavalina A sobre la actividad de la espermatolisina |
|
|---|---|
|
Pretratamiento |
Efecto lítico |
Ringer |
+ |
|
Concanavalina A ( 500 ug / ml) |
- |
| Concanavalina A (250 ug / ml ) | - |
| Concanavalina A (125 ug / ml) | - |
| Concanavalina A ( 60 ug / ml ) | - |
| Concanavalina A ( 30 ug / ml ) | - |
|
Ovocitos de cavidad condicionados de Bufo arenarum se pretrataron con diferentes concentraciones de concanavalina A (disuelta en Ringer
|
|
| Tabla 21 | |
Inhibición del efecto de la Concanavalina A sobre la membrana vitelina |
|
|---|---|
|
Pretratamiento |
Efecto lítico |
Ringer |
+ |
|
Concanavalina A (60 ug / ml) |
- |
| Concanavalina A (30 ug / ml ) | - |
| Concanavalina A (60 ug / ml) + alfa-Metil-D-Manosido 0,2 M | + |
| Concanavalina A ( 30 ug / ml )+ alfa-Metil-D-glucosido 0,2 M | + |
| Concanavalina A ( 60 ug / ml )+
|
+ |
|
El procedimiento seguido es similar al de la Tabla 20, salvo en aquellos casos en que se agregó al medio de pretratamiento los azúcares en las concentraciones finales que se señalan en la Tabla.. |
|
Para localizar el punto de acción de la concanavalina A, se recurrió a un
método citoquímico.
La observación de los cortes al microscopio electrónico (Fig.
14) mostró que el producto de reacción se encuentra distribuido uniformemente en la porción externa de la membrana vitelina. Los cortes también revelaron que los gránulos corticales de los ovocitos se encuentran intactos, por lo que no puede argüirse que su efecto sea mediado a través del mecanismo preventivo de la polispermia. Los controles no pretratados con concanavalina A no presentan en cambio dicha reacción.
Cuando los ovocitos sin ganga son pretratados con concanavalina A se obtiene una inhibición de la fecundación
(Tabla 22 ). Dado que los espermatozoides de Bufo arenarum son aglutinados por la concanavalina A , al igual que los de otras especies
(![]() ), se tuvo especial cuidado para que la misma no quedase en el medio de inseminación. En estas condiciones son suficientes
10 ug/ml para obtener una inhibición significativa de la fecundación. Esta Inhibición llega al 100% cuando se utilizan concentraciones mayores.
), se tuvo especial cuidado para que la misma no quedase en el medio de inseminación. En estas condiciones son suficientes
10 ug/ml para obtener una inhibición significativa de la fecundación. Esta Inhibición llega al 100% cuando se utilizan concentraciones mayores.
| Tabla 22 | |
| Efecto de la Concanavalina A sobre la fecundación de los ovocitos sin ganga | |
|---|---|
|
Concanavalina A (ug / ml) |
Ovocitos fecundados(%) |
-- |
85,2 ± 7,5 |
|
10 |
25,2 ± 5,2 |
| 30 | 0,0 ± 0,0 |
| 60 | 0,0 ± 0,0 |
|
Grupos de aproximadamente 25 ovocitos de cavidad condicionados se pretrataron con 0,500 ml de concentraciones crecientes de concanavalina A disuelta en Ringer
|
|
Cuando se utilizan ovocitos con ganga, se necesitan concentraciones mayores para bloquear la fecundación (
Tabla 23 ).
| Tabla 23 | |
|
Efecto de la Concanavalina A sobre la fecundación de los ovocitos con ganga |
|
|---|---|
|
Concanavalina A (ug / ml) |
Ovocitos fecundados(%) |
-- |
96,4 ± 1,5 |
|
30 |
68,4 ± 9,6 |
| 60 | 53,8 ± 11,3 |
| 125 | 15,4 ± 3,0 |
| 250 | 6,4 ± 3,0 |
| 500 | 1,0 ± 1,0 |
| 1000 | 0,0 ± 0,0 |
|
Tiras de aproximadamente 25 ovocitos se pretrataron con 0,500 ml de concentraciones crecientes de
Concanavalina A disuelta en Ringer |
|
Si el tratamiento con concanavalina A se realiza luego de la fecundación, en idénticas condiciones, no hay inhibición de la segmentación. Por lo tanto, el efecto de la misma se ejerce sobre algún punto del mecanismo de la fecundación.
Al igual que en el caso de su efecto sobre la acción de la lisina, hemos tratado de determinar si en nuestras condiciones de trabajo, la inhibición producida por la concanavalina A estaba relacionada con su propiedad de unirse a ciertos carbohidratos. Si al medio de incubación de los ovocitos con concanavalina A se agregan los sacáridos que inhiben su acción
(![]() ) Se observa una disminución significativa del efecto inhibitorio de la concanavalina A
(Tabla 24 ).
) Se observa una disminución significativa del efecto inhibitorio de la concanavalina A
(Tabla 24 ).
| Tabla 24 | |
|
Inhibición del efecto de la Concanavalina A sobre la fecundación |
|
|---|---|
|
Agregado al medio de incubación |
Ovocitos fecundados(%) |
-- |
0 |
| alfa-Metil-D-Manosido (0,2 M) |
39,2 ± 12,7 |
| alfa-Metil-D-glucosido (0,2 M) | 12,7 ± 2,8 |
|
34,2 ± 11,4 |
|
|
Ovocitos de cavidad condicionados se incubaron con una concentración de 60 ug / ml de concanavalina A. Al medio de incubación se agrego, en cada caso, los respectivos inhibidores en las concentraciones finales que se señalan en la Tabla. Luego de 30 minutos las muestras se procesaron al igual que en la
Tabla 22. |
|
Si al medio de incubación se agregan membranas vitelinas sonicadas, obtenidas a partir de ovocitos cavitarios, se consigue un efecto semejante
(Tabla 24).
Estos resultados coinciden con el efecto que ejerce esta lectina sobre la lisis. Si bien no se descarta un eventual efecto sobre otros puntos de la interacción ovocito-espermatozoide, nuestras experiencias nos permiten concluir que la concanavalina A inhibiría la fecundación impidiendo el ataque de la membrana vitelina por parte de las proteinasas acrosómicas.
![]()
|