Mecanismo de
acción de las enzimas

Enzimas | Especificidad
|Clases de Enzimas | Mecanismo de acción enzimática
|Como realiza esta acción una
enzima? |Acompañantes no proteicos de las
enzimas | Enlaces |Glosario
| Bibliografía

[ Principal ] [ Arriba ] [ Enzimas ] [ Energía y Metabolismo ] [ CATABOLISMO CELULAR: respiración ] [ Glucólisis ] [ Fermentación ] [ La respiración celular: destino del ác. pirúvico en ambientes aerobios ] [ Ciclo de Krebs ] [ Glicolisis ] [ Diagrama del Ciclo de Krebs ] [ ATP Rendimiento ] [ Glosario ]

La actividad vital no es más que el desarrollo
de una serie de reacciones químicas entre un conjunto
de moléculas. Si un químico en un laboratorio realiza
estas reacciones lo normal es que el rendimiento
(cuantificado como la cantidad de producto deseado
frente a la cantidad total del producto) sea muy bajo,
mientras que esta misma reacción en un sistema
biológico tiene un rendimiento del 99% y se
realiza a una mayor velocidad. Esto se debe a la
existencia de catalizadores , la mayoría de los
catalizadores biológicos que se conocen son ENZIMAS.
| Las enzimas son proteínas altamente
especializadas que tienen como función la
catálisis o regulación de la velocidad de las
reacciones químicas que se llevan a cabo en los
seres vivos. |
Casi todas las reacciones químicas de
las células son catalizadas por enzimas, con la
particularidad de que cada enzima solo cataliza una
reacción, por lo que existirían tantas enzimas
como reacciones, y no se consumen en el proceso. Los
catalizadores no biológicos son inespecíficos.
En una reacción catalizada por enzima
(E),
los reactivos se denomina sustratos (S) , es decir la
sustancia sobre la que actúa la enzima. El sustrato es
modificado químicamente y se convierte en uno o más productos
(P).
Como esta reacción es reversible se expresa de la
siguiente manera:
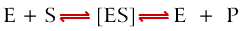
La enzima libre se encuentra en la misma
forma química al comienzo y al final de la reacción.
Las moléculas del sustrato se unen a un
sitio particular en la superficie de la enzima,
denominado sitio activo, donde tiene lugar la
catálisis. La estructura tridimensional de este sitio
activo, donde solo puede entrar un determinado sustrato
(ni siquiera sus isómeros) es lo que determina la
especificidad de las enzimas. El acoplamiento es tal que
E. Fisher (1894) enunció: "el sustrato se
adapta al centro activo o catalítico de una enzima como
una llave a una cerradura".
El nombre de las enzimas es el del sustrato
+ el sufijo: -asa. Los nombres de las enzimas
revelan la especificidad de su función:
-
Oxido-reductasas: catalizan
reacciones de oxido-reducción, las que implican la
ganancia (o reducción) o pérdida de electrones (u
oxidación). Las más importantes son las
deshidrogenasas y las oxidasas
-
Transferasas: transfieren
grupos funcionales de una molécula a otra. Ej.:
quinasas; transfieren fosfatos del ATP a otra
molécula.
-
Hidrolasas: rompen varios
tipos de enlaces introduciendo radicales -H y -OH.
-
Liasas: adicionan grupos
funcionales a los dobles enlaces.
-
Isomerasas: convierten los
sustratos isómeros unos en otros.
-
Ligasas o Sintasas: forman
diversos tipos de enlaces aprovechando la energía
de la ruptura del ATP. Ej: polimerasas
Una enzima, por sí misma, no puede
llevar a cabo una reacción, su función es modificar la
velocidad de la reacción, entendiéndose como tal la
cantidad de producto formado por unidad de tiempo.
Tal variación se debe a la disminución de la energía
de activación Ea; en una reacción
química, la Ea es la energía necesaria
para convertir los reactivos en formas moleculares
inestables denominadas especies en estado de
transición, que poseen mayor energía libre que los
reactivos y los productos.
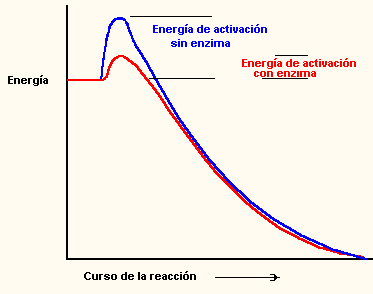
Imagen original de la Universidad de
Virginia
En el diagrama están representados los niveles de energía
, durante el curso de la reacción, de moléculas intervinientes en una reacción tipo:
A + B ---> C. La curva azul muestra el curso de la reacción en ausencia de
una enzima que facilite la reacción, mientras que la curva roja
la muestra en presencia
de la enzima específica de la reacción.
La diferencia en el nivel de energía entre el estado inicial y la necesaria para iniciar
la reacción
(picos de las curvas)
es la energía de activación.
Tal como se observa la presencia de enzima baja la energía de activación.
El complejo Enzima- sustrato posee menor
energía de activación que las especies en estado de
transición que la correspondiente reacción no
catalizada.
-
Orienta a los sustratos:
parte de la energía de activación se utiliza para
que los sustratos roten y se enfrenten con los
átomos correctos para formar los enlaces.
-
Agregan cargas a los sustratos:
las cadenas laterales (R) de los aminoácidos de las
enzimas pueden participar directamente haciendo a
los sustratos químicamente más reactivos.
-
Inducen la deformación en el
sustrato: cuando una sustancia se une al sitio
activo, la enzima puede causar que los los enlaces
se estiren, poniéndolo en un estado de transición
inestable.
-
Cambio de forma de la enzima al
unirse al sustrato: el modelo de llave-
cerradura de Fisher fue actualizado cuando se
descubrió que las enzimas son flexibles y sus
sitios activos pueden cambiar (expandirse) para
acomodarse a sus sustratos. Este cambio de forma
causado por la unión al sustrato se denomina ajuste
inducido.
En la Hexoquinasa puede
observarse este ajuste inducido, con el sustrato
(glucosa) y sin él. El ajuste inducido alinea las
cadenas laterales reactivas del sitio activo de la
enzima con los sustratos.
|