Cumarinas: La cumarinas están presentes en muchas plantas. La metil esculina fué identificada en Ruta, Avena e Imperata. Compuestos tales como escopolina, escopoletina y furanocumarinas tienen capacidad inhibitoria del crecimiento vegetal. Flavonoides: Una amplia variedad de flavonoides tales como floridzina (producida por Malus y algunas ericáceas) y sus productos de degradación tales como glicósidos de quempferol, quercetina y myrcetina son agentes alelopáticos bien conocidos. Taninos: Los taninos, tanto los hidrolizables como los condensados, tienen efectos inhibitorios debido a su capacidad para unirse a proteínas. Taninos hidrolizables comunes tales como los ácidos gálico, elágico, trigálico, tetragálico y quebúlico están ampliamente distribuidos en el reino vegetal. La mayoría están presentes en suelos de bosques en concentraciones suficientes para inhibir nitrificación. Los taninos condensados, los cuales se originan de la polimerización oxidativa de las catequinas, inhiben las bacterias nitrificantes en suelos forestales y reducen el ritmo de descomposición de la materia orgánica el cual es importante para los ciclos de circulación de minerales en el suelo.
Alcaloides: Pocos alcaloides se conocen con
actividad alelopática. Algunos como la cocaína, cafeína, cinconina,
fisostigmina, quinina, cinconidina, estricnina son reconocidos inhibidores de
la germinación. La cebada exuda por sus raíces la gramina que inhibe el
crecimiento de Stellaria media. La cafeína mata ciertas hierbas sin
afectar algunas especies cultivadas como, por ejemplo, el poroto. 4. Biosíntesis de los agentes alelopáticos
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
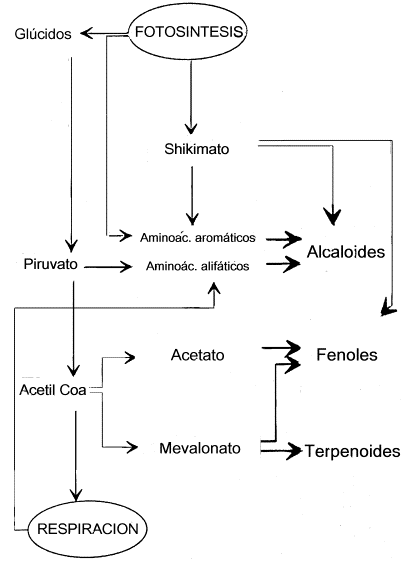 |
|
Fig. 2: Rutas de biosíntesis de aleloquímicos |
Una variedad de agentes alelopáticos son sintetizados y almacenados en diferentes células de la planta ya sea en forma libre o conjugada con otras moléculas y son liberados en el entorno en respuesta a diferentes stresses bióticos y abióticos. Muy poco se sabe sobre la liberación de aleloquímicos de tejido viviente, incluyendo los modos de regulación o influencia ambiental sobre esos procesos. Por ejemplo, ensayos con sorgo mostraron que al exponer semillas del mismo a radiaciones gamma, las plantas originadas exudaban por sus raíces mayor cantidad de agentes alelopáticos que plantas provenientes de simiente no sometida a dicho tratamiento. Por otra parte es un interrogante sin respuesta si los aleloquímicos son liberados en forma activa o a través de un escape pasivo. Existen sustancias exudadas por las raíces de ciertas plantas que no pueden aislarse de los tejidos radiculares de éstas. En sorgo las p-benzoquinonas, conocidas como sorgoleone, son exudadas en forma abundante por la raíz. Sin embargo no han sido encontradas en los tejidos radicales. De todas maneras, se puede afirmar que el modo de liberación de un agente alelopático depende de su naturaleza química. Las plantas superiores liberan regularmente compuestos orgánicos por volatilización de sus superficies y a través de lixiviados de hojas y exudados de raíces. Eventualmente, los constituyentes químicos de todos los organismos son liberados al entorno a través de procesos de descomposición, incorporándose a la matriz del suelo. Por tanto existen 4 vías principales de liberación al entorno de los aleloquímicos (Figura 3). A continuación analizaremos cada una de ellas.
|
|
| Fig. 3: Vías a través de las cuales se liberan los agentes alelopáticos al entorno |
La liberación de agentes alelopáticos por volatilización está frecuentemente confinada a plantas que producen terpenoides. Los géneros que comúnmente liberan compuestos volátiles incluyen Artemisia, Salvia, Parthenium, Eucalyptus y Brassica (Tabla 1). Estas sustancias han demostrado también actividad insecticida y como disuasivos alimenticios. La toxicidad de los compuestos volátiles es prolongada, debido a su adsorción a las partículas del suelo, lo cual les permite permanecer varios meses en él. En ecosistemas de desierto y mediterráneos, la liberación de compuestos alelopáticos a través de volatilización es frecuentemente observada, debido al predominio de altas temperaturas, e influencia la distribución de las especies vegetales
|
Nombre de la planta |
Efecto inhibitorio sobre la planta blanco |
Naturaleza química del compuesto volátil |
|
Salvia reflexa |
Germinación de semillas y crecimiento de plántulas. |
Monoterpenos, a-pineno, b-pineno, cineol. |
|
Brassica juncea Brassica napus Brasica rapa |
Germinación de lechuga y trigo. |
No determinada. |
|
Amaranthus palmeri |
Germinación de tomate, cebolla y zanahoria. |
2-Octanona, 2-nananona, 2-heptanona |
|
Eucalyptus globulus |
Germinación y crecimiento de plantas de cultivo. |
Variedad de terpenos |
|
Artemisia princeps var orientalis |
Es autotóxica e inhibitoria del desarrollo de callos de lechuga. |
No determinada. |
| Heliotropium europeum | Estimula el crecimiento de rabanito y trigo sarraceno. | No determinada. |
|
Tabla 1. Potencial alelopático de compuestos volátiles. |
||
La lixiviación es la remoción de sustancias presentes en la planta por efecto de la lluvia, nieve, niebla o rocío. El grado de lixiabilidad depende del tipo de tejido vegetal, la edad de la planta y la cantidad y naturaleza de la precipitación. De esta manera se liberan una gran variedad de agentes alelopáticos de diferente naturaleza tales como compuestos fenólicos, terpenos y alcaloides. Se ha determinado la toxicidad de muchos lixiviados de semillas y hojas sobre plantas silvestres y cultivadas (Tabla 2).
|
Tabla 2. Potencial alelopático de lixiviados |
||
|
Nombre de la planta |
Efecto inhibitorio sobre la especie blanco |
Naturaleza química |
|
Datura stramonium |
Crecimiento de trigo y soja. |
Escopolamina, hyoscyamina. |
|
Brassica rapa (L.)
Brassica napus |
Crecimiento de cebada, centeno y rabanito. Germinación de soja |
No determinado.
Alilisotiocianato |
|
Artemisia |
Crecimiento de cebada, lechuga crisantemo. |
No determinado. |
|
Eucalyptus globulus |
Crecimiento de plantas de cultivo. |
No determinado. |
|
Calmintha ashei |
Germinación y crecimiento de Rudberkia hirta y Leptochloa dubia |
(+) Evodona y desacetil calaminthona. |
La reducción en rendimiento observada en algunos cultivos en varios casos se ha atribuído a toxinas liberadas por otros y malezas adyacentes. Se conocen sustancias exudadas por las raíces que reducen la germinación de las semillas, el crecimiento de raíces y brotes, la incorporación de nutrientes y la nodulación. (Tabla 3). Los exudados radiculares comprenden unicamente entre el 2-12% del total de fotosintatos de la planta. La mayoría de los agentes alelopáticos conocidos son exudados radiculares. Factores tales como la edad del vegetal, nutrición, luz y humedad influencian cuali y cuantitativamente la liberación de sustancias por las raíces.
Los residuos en descomposición de la planta liberan una gran cantidad de agentes alelopáticos. Los factores que influencian este proceso incluyen la naturaleza del residuo, el tipo de suelo, y las condiciones de descomposición. Eventualmente las sustancias alelopáticas liberadas por los residuos vegetales en el suelo entran en contacto con las raíces de plantas presentes en el mismo ejerciendo su acción. (Tabla 4). Los compuestos liberados por la planta al suelo sufren frecuentemente transformaciones realizadas por la microflora del mismo, que pueden originar productos con actividad biológica mayor que sus precursores. Investigaciones utilizando extractos acuosos vegetales han demostrado que los inhibidores solubles en agua presentes en la planta de cultivo pueden ser rápidamente liberados durante el proceso de descomposición.
|
Tabla 3. Potencial alelopático de algunos exudados de raíces |
|||
|
Nombre de la planta |
Efecto inhibitorio sobre la especie blanco |
Naturaleza química |
|
|
Elytrigia repens |
Crecimiento de raíces, materia seca, nodulación y fijación de nitrógeno. |
No determinada. |
|
|
Chenopodium murale |
Longitud de vástago y espiga y peso seco en trigo |
No determinada |
|
|
Avena spp. |
Crecimiento de raíz y brote y longitud de espiga en trigo. |
Escopoletina y ácido vainíllico. |
|
|
Bidens pilosa |
Area foliar, crecimiento y material seca en maíz, sorgo y lechuga. |
No determinada. |
|
|
Celosia argentea L. |
Nodulación en Cajanus cajan y Vigna aconitifolia. |
No determinada. |
|
|
Parthenium hysterophorus |
Crecimiento y nodulación de poroto. |
No determinada. |
|
|
Medicago sativa |
Crecimiento de soja, maíz, cebada y rabanito. Cultivo de suspensiones celulares de repollo y tomate. |
No determinada. Canavanina |
|
|
Lycopersicum esculentum |
Crecimiento de lechuga y berenjena. |
No determinada. |
|
|
Brassica campestris |
Crecimiento de mostaza y autotóxico. |
No determinada. |
|
|
Cucumis sativus |
Crecimiento de lechuga. |
Acidos benzoico, clorogénico, mirístico y palmítico. |
|
|
Avena spp. |
Crecimiento de trigo. |
Escopoletina y ácidos benzoico, cumárico y vainíllico. |
|
|
Asparagus officinalis |
Autotóxico |
No determinada |
|
|
Triticum aestivum |
Crecimiento de avena salvaje. |
Acido hidroxámico |
|
|
Rorippa sylvestris |
Crecimiento de plántulas de lechuga. |
Hirsutina y pirocatecol, ácidos p-hidroxibenzoico y vainíllico |
|
La toxicidad originada en los residuos de plantas proporciona algunos problemas y oportunidades importantes para agrónomos y mateólogos. Por ejemplo, prácticas agrícolas como la siembra directa sobre rastrojo destinadas a una mejor conservación de agua y suelo no son aconsejables para ciertas combinaciones de cultivos por los efectos nocivos de las toxinas liberadas de los residuos en descomposición sobre la emergencia, crecimiento y productividad del cultivo siguiente. Por otro lado, también los residuos pueden afectar de igual manera a ciertas malezas.
|
Tabla 4. Potencial alelopático de los residuos en descomposición. |
||
|
Nombre de la planta |
Efecto inhibitorio sobre la especie blanco |
Naturaleza química |
|
Agropyron repens |
Crecimiento de plantines de alfalfa, maíz y soja. |
Ácido 5-hidroxi indol,3-acético. |
|
Parthenium hysterophorus |
Germinación de semillas de Brassica napus. |
Partenina, coronopilina y ácidos cafeico, p-cumárico, clorogénico, cumárico, hidroxibenzoico y vainíllico. |
|
Sorghum halepense L. |
Germinación y crecimiento de girasol, tomate y rabanito. |
Acidos clorogénico, cumárico, hidroxibenzoico y vainíllico. |
|
Cyperus rotundus L. |
Rendimiento de tomate, arroz, repollo, pepino, zanahoria, soja y algodón. |
Polifenoles y sesquiterpenos. |
|
Cyperus esculentus L. |
Germinación y crecimiento de remolacha azucarera, lechuga, arveja, tomate, maíz, soja y tabaco. |
Acidos ferúlico, hidroxibenzoico, siríngico y vainíllico. |
|
Setaria viridis L. |
Crecimiento de soja, maíz y sorgo. |
No determinada. |
|
Chenopodium album y C. murale |
Germinación y crecimiento de trigo, centeno, maíz, soja, mostaza y garbanzo. Incorporación de nutrientes en maíz, soja y tomate. |
No determinada. |
|
Imperata cylindrical |
Crecimiento de maíz, centeno, sorgo y tomate. |
Escopolina, Escopoletina y ácidos benzoico, clorogénico, cumárico, gentísico y vainíllico. |
|
Xanthium spp. |
Germinación y crecimiento de trigo, maíz, tabaco, garbanzo, repollo y lechuga. |
Acidos Benzoico, cafeico, clorogénico y cumárico. |
|
Artimisia princeps |
Crecimiento,peso seco y contenido calórico de Lactuca, Plantago, Chrysantemum y Achryranthus. |
No determinada. |
6.1 Limitaciones en el estudio de los mecanismos de acción
Debido a la diversidad de naturalezas químicas de los diferentes agentes alelopáticos, no existe un mecanismo de acción único que explique la manera en que éstos afectan a la planta receptora. La compresión del mecanismo de acción de un compuesto alelopático determinado tiene varios inconvenientes. En condiciones naturales las cantidades en que se encuentran disponibles muchas de estas sustancias son inferiores a las que presentan actividad en bioensayos en laboratorio. Esto se debe a que frecuentemente existen interacciones sinérgicas y aditivas, lo cuál dificulta determinar la actuación de cada compuesto. Esa presencia mínima de sustancia también dificulta su recuperación para ser utilizados en estudios de efectos fisiológicos y a nivel subcelular. Estudiando un agente alelopático en particular, muchas veces es difícil diferenciar efectos secundarios de la causa primaria de acción. La importancia del estudio de cómo actúan estas sustancias es evidente si se tiene en cuenta que son aproximadamente sólo doce los sitios moleculares de acción conocidos de los herbicidas actualmente utilizados en agricultura y entre las malezas es logarítmico el ritmo de aparición de resistencias a los productos comerciales en uso. Se deduce fácilmente que la utilización de sustancias con nuevos sitios de acción diferentes a los explotados hasta el momento permitiría reducir el impacto de éste problema.
La literatura nos brinda alguna comprensión de los mecanismos de acción de agentes alelopáticos pero, por todo lo señalado anteriormente, falta todavía más claridad respecto a cómo afectan el crecimiento de las plantas receptoras. Los más estudiados hasta el presente en este aspecto son los compuestos fenólicos. Es una aproximación interesante seguir la trayectoria de estas sustancias a través de la planta mediante moléculas de las mismas marcadas con C14. Esto permite entender a qué partes son predominantemente transportados y en qué tejidos es factible que ejerzan su acción. Los primeros estudios de este tipo mostraron que semillas en germinación de lechuga (Lactuca sativa) y cebada son capaces de incorporar cumarina y los ácidos cinámico, cafeico y ferúlico. Otros trabajos con plantines indican que los ácidos salicílico, ferúlico y p-hidroxibenzoico son rápidamente extraídos de medios nutritivos y traslocados a través de la planta. Desgraciadamente, no se han utilizado moléculas marcadas con radioisótopos para la mayoría de los agentes alelopáticos. A continuación se analizarán diferentes aproximaciones destinadas a comprender los mecanismos de acción de estas sustancias.
6.2 Alteraciones hormonales provocadas por agentes alelopáticos
Los compuestos fenólicos pueden reducir o incrementar la concentración de Acido Indol Acético (AIA), una fitohormona del grupo de las auxinas. Monofenoles tales como los ácidos p-hidroxibenzoico, vainíllico, p-cumárico y siríngico reducen la disponibilidad de AIA promoviendo su decarboxilación. En contraste, muchos di y polifenoles (p. ej. los ácidos clorogénico, cafeico, ferúlico y protocatécuico) sinergizan el crecimiento inducido por AIA suprimiendo la degradación de la hormona. Estos resultados sugirieron que existiría un control en los niveles de AIA a través del balance entre mono y polifenoles. La enzima polifenoloxidasa, actúa sintetizando polifenoles a partir de fenoles simples. Su actividad regularía por tanto la destrucción y preservación de la auxina.
Ciertos glicósidos de flavonoides como la naringenina, la 2´,4,4´-trihidroxichalcona y la floridzina estimulan fuertemente enzimas del tipo AIA oxidasa, involucradas en la degradación de auxinas.
Los ácidos hidroxámicos 6,7-dimetoxi-2-benzoxazolinona (DIMBOA) y 6-metoxi-2-benzoxazolinona (MBOA) modifican la afinidad de unión de las auxinas a sitios receptores de unión de las mismas a membrana. Esta actividad guarda correlación con la inhibición de crecimiento inducido por auxinas en secciones de coleóptilo de avena. Por ello se ha propuesto que la toxicidad de los ácidos hidroxámicos sería debida a la interferencia que provocan en la actividad normal de las auxinas.
|
|
|
Fig. 4: Modelo propuesto para relacionar la acción deletérea de aleloquímicos fenólicos. Las flechas sugieren un impacto negativo sobre los procesos y las superposiciones sombreadas implican interacciones probables entre dominios. |
El etileno es una importante hormona vegetal cuya síntesis es estimulada por las auxinas en muchos tipos de células vegetales. A pesar de los efectos observados sobre los niveles de éstas últimas descriptos anteriormente, hasta el presente no se han detectado cambios que se espera provocarían los mismos sobre los niveles de etileno. Es importante destacar que el etileno se puede considerar también un agente alelopático, siendo liberado en cantidades significativas por los residuos vegetales en descomposición con capacidad para provocar retardo en la elongación de tallos y raíces.
Varios compuestos fenólicos inhiben la acción de otras fitohormonas, las giberelinas, ya sea por unión a la molécula hormonal o por bloqueo del proceso mediado por las mismas. Se sabe que los ácidos ferúlico, p-cumárico, vainíllico y las cumarinas inhiben el crecimiento inducido por giberelinas. Muchos taninos también lo hacen, provocando paralelamente una reducción en la síntesis de enzimas hidrolíticas tales como la amilasa y la fosfatasa ácida en endosperma de semillas de cebada. En simiente de maíz el ácido ferúlico provoca un efecto similar.
El ácido abscísico (ABA), es una hormona vegetal cuyo incremento en la planta normalmente está asociado a una condición de stress fisiológico. Un stress hídrico conduce a un incremento en los niveles de esta sustancia provocando el cierre de estomas. Aparentemente la cumarina y varios flavonoides tienen actividad antagónica contra el efecto inhibitorio del ABA y estimulan el crecimiento inducido por el ácido giberélico. La inhibición de crecimiento de plántulas de pepino debida a ácido ferúlico y otros compuestos fenólicos ha sido correlacionada con el incremento en los niveles de ácido abscísico.
En definitiva, parece que muchos compuestos fenólicos son capaces de provocar alteraciones en el balance hormonal de la planta receptora, lo cual en ciertos casos conducen a una inhibición del crecimiento. Tal vez, algunas sustancias de esta naturaleza de origen endógeno tengan algún rol en la regulación del crecimiento en la propia planta productora.
6.3 Efectos sobre la actividad enzimática
Existen muchos compuestos alelopáticos con capacidad de modificar ya sea la síntesis o la actividad de enzimas tanto in vivo como in vitro. La mayoría de estas sustancias han demostrado un efecto dual sobre la regulación de la actividad enzimática. Provocan un incremento en ésta última cuando se encuentran en bajas concentraciones. En la situación opuesta se observa una reducción de actividad. Por ejemplo, plántulas de maíz tratadas con ácido ferúlico mostraron un incremento en los niveles de enzimas oxidativas (peroxidasas, catalasa y ácido indol acético oxidasa) junto con una elevación de enzimas de la ruta del ácido shikímico tales como fenil alanina amonio liasa y la cinamil alcohol deshidrogenasa involucrada en la síntesis de compuestos fenilpropanoides. También al ácido ferúlico se le atribuye la inhibición de enzimas hidrolíticas tales como amilasa, maltasa, invertasa, proteasa y fosfatasa ácida involucradas en la movilización de material de alimento.
6.4 Efectos sobre la fotosíntesis
Se han realizado experimentos con plantas enteras, suspensiones de células y cloroplastos para averiguar si los agentes alelopáticos eran capaces de inhibir el proceso fotosintético. Bioensayos con Abutilon teophrasti y Lemna minor demostraron que varios ácidos derivados del benzoico y el cinámico (p. ej. el ácido ferúlico), escopoletina y clorogénico en bajas concentraciones eran capaces de inhibir la fotosíntesis de plantas enteras. Experimentos con suspensiones de células foliares de Abutilon teophrasti, mostraron que el ácido ferúlico, p-cumárico, clorogénico y vainíllico son capaces de inhibir la fotosíntesis con concentraciones de los aleloquímicos menores a las requeridas para planta entera. Es necesario aclarar que el efecto inhibitorio del agente alelopático sobre la fotosíntesis no necesariamente acontece en los eventos primarios del proceso, sino como resultado de una modificación en los niveles de clorofila o por cierre de los estomas y la subsecuente reducción en la provisión de CO2 vital para la producción de fotosintatos. En soja los ácidos ferúlico, vainíllico y p-cumárico reducen el contenido de clorofila. En sorgo, las mismas sustancias no provocan esa disminución. Los ácidos ferúlico, p-cumárico y otros cinámicos a bajas concentraciones revierten el cierre de estomas mediado por ABA y estimulan la fotosíntesis. A concentraciones altas, sin embargo, provocan el cierre de los estomas e inhibición del proceso fotosintético. La experimentación con cloroplastos permite eliminar la interferencia de los factores indicados. Los ácidos fenólicos actúan en concentraciones relativamente altas inhibiendo el transporte de electrones lo que sugeriría según Einhellig que el sitio blanco de acción de estas sustancias es otro. Ciertos flavonoides parecen interferir en la organización funcional o estructural del cloroplasto. El quempferol, por ejemplo, aparentemente actúa como un inhibidor de transferencia de energía, impidiendo la síntesis de ATP. Un caso especial son las quinonas. Existen compuestos sintéticos de esta naturaleza que son empleados como herbicidas. Algunas de origen natural son reconocidos agentes alelopáticos como el sorgoleone y la juglona. El sorgoleone, una benzoquinona presente en los exudados radiculares de sorgo, a concentraciones similares a las empleadas con el herbicida atrazina, es capaz de desacoplar el transporte de electrones en el fotosistema II. La juglona afecta también la evolución del oxígeno en el cloroplasto, sin aparentemente desacoplar la fotofosforilación. Compuestos de otro tipo como el alcaloide gramina también provocan desacople en el transporte de electrones.
6.5 Efectos sobre respiración
Para estudiar el efecto de los aleloquímicos sobre la respiración, normalmente se ensayan los mismos sobre suspensiones mitocondriales. Entre los compuestos fenólicos el orden de mayor a menor actividad es quinonas > flavonoides > cumarinas > ácidos fenólicos. Las quinonas sorgoleone y juglona son efectivos inhibidores a muy baja concentración. Nuevamente el sorgoleone afecta el transporte de electrones, mientras que la juglona afecta la incorporación mitocondrial de oxígeno.
Flavonoides tales como la quercetina, naringenina y umbeliferona inhiben la producción de ATP en la mitocondria.
6.6 Efectos sobre procesos asociados a membranas
Los derivados de los ácidos benzoico y cinámico tienen profundos efectos sobre las membranas. Son capaces de provocar cambios en la polaridad lo cual provocaría alteraciones en la estructura y permeabilidad de las mismas. Otras sustancias como el ácido hidroxibutírico también presente en rastrojos, provoca efectos similares.
Los ácidos fenólicos tienen un efecto directo sobre la incorporación de iones. Todos los ácidos benzoicos y cinámicos implicados en alelopatía inhiben el ritmo de incorporación de fósforo y potasio en raíces cortadas. También algunos flavonoides inhiben la absorción mineral. La inhibición de las ATPasas de membranas y la alteración en la permeabilidad de las mismas pueden contribuir a la reducción en la incorporación mineral. Estudios en sorgo muestran que el ácido ferúlico reduce los niveles de fosforo y potasio en la parte aérea y las raíces de la planta después de 3 a 6 días de tratamiento. Los contenidos de magnesio, hierro y calcio también se ven afectados. Se conocen efectos aditivos sobre la incorporación de minerales como el observado en la incorporación de fósforo por plantas de pepino (Cucumis sativus) cuando se las trata con una mezcla de los ácidos ferúlico, vainíllico y p-cumárico.
Los ácidos fenólicos también pueden alterar el contenido de minerales en la planta receptora. En Caupí (Vigna sinensis) bioensayos mostraron que los ácidos cafeico, siríngico, y protocatécuico reducen los contenidos en nitrógeno, fósforo, potasio, hierro y molibdeno, pero los niveles de magnesio no son alterados. Experiencias a lo largo de 7 semanas con el ácido clorogénico en Amaranthus retroflexus mostraron alteraciones en los contenidos minerales de ésta especie. Los niveles de fósforo descendieron y se incrementaron los de nitrógeno, sin sufrir alteraciones los de potasio.
Los ácidos fenólicos y las cumarinas alelopáticas también provocan alteraciones en el contenido de agua en la planta. Para estudiar su variación se determinaron las relaciones de isótopos de carbono asimilados en tejido foliar. Se observó una alteración crónica en la eficiencia en el uso del agua por exposición sostenida a diferentes aleloquímicos fenólicos a concentraciones cercanas a las que inhiben el crecimiento. Por ejemplo, el ácido ferúlico reduce la incorporación de agua por las raíces. Paralelamente, eleva los niveles endógenos de ABA. También se ha demostrado que combinaciones de estos compuestos son capaces de provocar el mismo efecto.
6.7 Modelo de acción alelopática de compuestos fenólicos
Según Einhellig, si bien muchos compuestos fenólicos actuarían a nivel celular simultáneamente en varios blancos alterándola fisiologicamente, parece que algunos efectos son mas importantes que otros y es central la acción que estas sustancias tienen sobre membrana plasmática para provocar la interrupción de la mayoría de los restantes procesos en que están involucrados (Figura 4 y 5).
|
|
|
Fig. 5: Modelo que ilustra los sitios de acción de
agentes alelopáticos del sorgo en la fisiología celular. Algunos sitios
primarios de acción deletérea están sugeridos por flechas. |
La investigación de un fenómeno alelopático es compleja. Esto se debe fundamentalmente a que el metabolito luego de su liberación al entorno puede sufrir transformaciones que aumenten o disminuyan su actividad antes de tomar contacto con la especie receptora. Por ejemplo, si el aleloquímico es una sustancia presente en el suelo, la microflora puede transformarlo. A su vez, la actividad de la misma dependerá de su composición cuali y cuantitativa la cual está sujeta a la acción de factores abióticos(p. ej. humedad y temperatura) o bióticos (p. ej. exudados microbianos).
En forma general la investigación en alelopatía comprende 2 etapas:
Fase biológica – ecológica.
Fase química – analítica.
Fase biológica – ecológica: Se observa si en condiciones de campo existe una aparente interacción negativa severa entre plantas. Esta puede visualizarse, entre otros, como zonas de suelo desnudo alrededor de vegetación arbustiva, cobertura vegetal rala bajo un grupo de árboles, persistencia de un estado particular dentro de la sucesión vegetal o impedimento del desarrollo o reducción del rendimiento en un cultivo infestado con una maleza agresiva en particular.
El siguiente paso es determinar si competencia, alelopatía u otro proceso (un patógeno vegetal, una plaga, etc) es responsable de la reducción de crecimiento observada en la especie afectada. Normalmente si el efecto observado no puede atribuirse a variables físicas ambientales (pH, temperatura, nutrientes minerales y contenido de agua), ni a los procesos indicados anteriormente, se considera que la alelopatía es la causa.
A continuación, debe determinarse el mecanismo de liberación y el camino por el cual se mueve el supuesto aleloquímico en el medio. Los métodos de extracción deben tratar de simular las rutas de entrada de las sustancias tóxicas al entorno natural. En el cuadro 1 se recomiendan algunos.
Procedimientos drásticos como los que involucran el uso de solventes orgánicos o agua en ebullición no son recomendables. Estos pueden llevar a la detección de fitotoxinas que en condiciones naturales están física o químicamente unidas de tal forma que no podrían actuar en la inhibición de crecimiento vegetal.
|
Cuadro 1. Métodos de extracción de sustancias a partir de diferentes materiales de origen vegetal. |
|
|
Recuperación de lixiviados |
Materiales |
| Empapado con agua fría | Hojas frescas o secas Raíces frescas o secas Residuos de raíces Residuos de hojas |
| Mojado con niebla o rocío | Hojas en planta entera |
|
Recuperación de exudados radiculares |
|
| Sistemas de recirculación | Suelo en torno a raíces en planta entera |
|
Recuperación de sustancias volátiles |
|
| Trampas de gases enfriadas con hielo seco | Aire en torno a la planta entera |
Para el estudio de una alelopatía en particular debe establecerse un bioensayo standard seleccionando especies blanco convenientes y se bioensayan los compuestos colectados anteriormente evaluado cambios en tamaño y peso en los órganos de éstas. Son frecuentes los bioensayos de germinación de semillas y crecimiento de plántulas. También se han diseñado bioensayos con plantas enteras (p. ej. Lemna minor). Las especies blanco se seleccionan de acuerdo al objetivo que se persigue (p. ej. corroborar la sensibilidad a un aleloquímico de una supuesta especie receptora que se observó en campo). Es aconsejable seleccionar especies que presenten germinación uniforme, sensibilidad a gran variedad de aleloquímicos especialmente a bajas concentraciones de los mismos y crecimiento rápido. De esta manera en el análisis estadístico de la información se pueden obtener bajos coeficientes de variación y la más alta significación para los parámetros de crecimiento mensurables( p. ej. longitud de raíz y vástago). En el cuadro 2 se indican algunos métodos frecuentemente utilizados en bioensayo.
| Cuadro 2. Métodos frecuentes de bioensayo. Se indica qué se bioensaya y soportes utilizados. |
|
I_Extractos (Caja de Petri,
Suelo y Arena) |
Fase química-analítica: Si un efecto fitotóxico puede demostrarse a través de los bioensayos, se procede al aislamiento e identificación de los aleloquímicos responsables. Métodos de concentración y aislamiento se dirigen de acuerdo a la actividad biológica observada en bioensayos acoplados a ellos. La disponibilidad de técnicas tales como las cromatografías en capa fina, en papel, líquida de alta presión (HPLC) y gaseosa acoplada a espectrómetro de masas, permiten la identificación de la mayoría de los compuestos aislados.
Por último, una vez identificado el agente alelopático, debe detectarse su presencia en la parte del entorno ( aire, suelo, solución del suelo) a través de la cual estaría ejerciendo su acción en la concentración adecuada para causar la inhibición de la planta receptora. Esto es especialmente problemático, ya que los compuestos biologicamente activos frecuentemente se encuentran en concentraciones muy bajas en el suelo, lo cual difículta la extracción y detección de los mismos.
Muchos autores
enfatizan que no se puede emplear una sola técnica para probar la presencia o
no de un fenómeno alelopático. Los criterios expresados anteriormente,
considerados en conjunto, pueden ser muy útiles en la evaluación de la naturaleza
de un fenómeno de interferencia en particular.
En este
capítulo se explicó que se entiende por alelopatía y se describieron las
principales características del fenómeno. Para finalizar, analizaremos la
importancia del conocimiento del mismo.
La agricultura
moderna utiliza extensivamente agroquímicos, los cuales tienen un fuerte
impacto ambiental y en muchos casos constituyen un serio riesgo a la salud
humana. Las investigaciones en alelopatía en algunos casos permiten plantear
estrategias orientadas a una mayor sustentabilidad de los sistemas de
producción agrícola, con un menor consumo en insumos contaminantes. Para lograr
un mejor aprovechamiento de los agentes alelopáticos es necesario ampliar el
conocimiento de los mismos en relación a la rotación de cultivos, manejo de
residuos, prácticas de labranza y la implementación de control biológico de
malezas.
En condiciones de campo se ha observado que el sorgo, el girasol y otros cultivos reducen el uso de herbicidas tanto durante el desarrollo de los mismos como en años siguientes. Cultivos de cobertura y sus residuos, tales como centeno, avena, cebada, trigo, sorgo granífero y sudangrass son efectivos en la reducción del crecimiento de malezas. Se han ensayado diferentes modos para su empleo:
Cultivada el año anterior.
Supresión directa de la población de malezas cuando ellos son el cultivo.
Como cultivo de cobertura de suelo en quintas o huertos con subsecuente desecación utilizando herbicidas o por heladas.
En secuencias de cultivos (p.ej.: sembrar como cultivo invernal trigo y maíz como cultivo estival sobre los rastrojos dejados por el primero).
Rotación de cultivos con siembra directa del cultivo del segundo año sobre rastrojos dejados por la especie
Se ensayó también cultivar conjuntamente una especie que controla malezas con otras cuya producción es de interés (p.ej. centeno y soja sembrados juntos). La limitación de este enfoque es que el cultivo que controla malezas puede interferir en el acompañante provocando reducción de rendimiento.
Otra aproximación es el de intercalar 2 o mas cultivos cosechables, donde alguno de ellos tiene actividad alelopática sobre malezas. El cultivo intercalado de maíz con zapallo ha demostrado ser efectivo en el control de malezas del primero. Se detectaron aleloquímicos liberados por esa cucurbitacea que afectan malezas normalmente perjudiciales al maíz.
Debido a la importancia del control de malezas, los enfoques indicados pueden ser empleados sin una comprensión completa de los mecanismos de interferencia involucrados. El uso de plantas superiores como herbicidas biológicos, incluídas especies no cultivadas para controlar malezas ha recibido escasa atención. Sin embargo se conoce, por ejemplo, que Euphorbia esula, una de las peores malas hierbas de las llanuras del norte de Estados Unidos, no invade zonas ocupadas por Artennaria microphylla. Se cree que esto es debido a la sensibilidad a sustancias producidas por esta ultima. En plantaciones de citrus en Florida Lantana camara y Morrenia odorata son malezas importantes. Se observó que en campos ocupadas por Lantana no crece Morrenia. Bioensayos indicaron que L. Camara tendría efecto alelopático sobre Morrenia. Tal vez en el futuro se puedan emplear malezas con actividad alelopática de poca incidencia sobre determinados cultivos contra otras mas graves que se presentan normalmente en los mismos.
Por último, debe señalarse nuevamente que el conocimiento de los modos de acción de los agentes alelopáticos es clave para la exploración del uso de los mismos como herbicidas. Esto usualmente ofrece herramientas para combatir la evolución de resistencias a biocidas de malezas actualmente utilizados y alternativas para aquellos para los cuales la resistencia ya existe.
Los ensayos de germinación y los de crecimiento de plántulas son ampliamente utilizados debido a que son sencillos y permiten una evaluación rápida de la respuesta de una especie vegetal a un agente alelopático determinado. A través del siguiente experimento se pretende que el lector tenga una mejor comprensión del diseño de un bioensayo en alelopatía. Se probará, además la actividad inhibitoria de la germinación de algunos agentes alelopáticos conocidos. Como especie receptora se puede utilizar cualquier maleza o cultivo. Macías explorando el posible uso de agentes alelopáticos como herbicidas, señaló que las malezas mas comunes pertenecen a las familias compositae, umbeliferae, verbenaceae, cruciferae, solanaceae, liliaceae y gramínea. En base a ello propuso las siguientes especies receptoras:
| Dicotiledóneas | Cruciferae | Lepidium sativum L. (Berro) |
| Compositae | Lactuca sativa L. (lechuga) | |
| Solanaceae | Lycopersicum esculentum L. (Tomate) | |
| Umbeliferae | Daucus carota L. (Zanahoria) | |
| Monocotiledóneas | Liliaceae | Allium cepa (Cebolla) |
| Graminae | Triticum aestivum L. (Trigo) Hordeum vulgare L. (Cebada) Zea mays L. (Maíz) |
Comercialmente se pueden obtener agentes alelopáticos tales
como cumarina, ácido hidroxicinámico, juglona, pirocatecol y los ácidos p-hidroxibenzoico,
vainíllico, clorogénico, ferúlico y gálico. Las pruebas de germinación se
conducen en cajas de Petri de 9 cm de diámetro conteniendo discos de papel de
filtro completamente humedecidos con un volumen constante (4 a 8 ml) de la solución de prueba. Debido
a la solubilidad limitada en agua de algunos aleloquímicos Williams y Hoagland
sugirieron la disolución de cantidades adecuadas de estas sustancias
inicialmente en Dimetilsulfóxido (DMSO) y luego diluir en agua a la
concentración deseada. Contenidos de 0,05%
(v/v) de DMSO no tendrían efecto sobre la germinación. Los testigos
deben contener igual concentración de DMSO para evitar falsos resultados. Se
sugieren concentraciones de 5 x 10-3 M, 1 x 10 -3 M, 1 x
10-4 M y 1 x 10-5 M. Posibles efectos aditivos o
sinergismos pueden evaluarse usando combinaciones de varios de estos
aleloquímicos. Cuatro cajas de petri, cada una conteniendo 20 semillas,
deberían ser usadas para cada concentración de los agentes alelopáticos. Las
cajas de Petri conteniendo las diluciones de prueba y las semillas deberían ser
incubadas con luz suave a 25 ºC con lectura de la germinación después de 1,3 y
5 días. Debe compararse la germinación de cada una de las soluciones de prueba
contra la del control.
Por último, con la información obtenida constrúyase curvas de
porcentaje de germinación en función de los días para cada concentración de
aleloquímico, para los diferentes agentes alelopáticos y especies receptoras.
Comparar la respuesta de las diferentes especies a las sustancias ensayadas.
Metabolito secundario: Compuestos sintetizados por la planta que no se necesitan para el crecimiento y desarrollo normal de las rutas metabólicas comunes a todos los vegetales.
Aleloquimia: Fenómeno en el cual un compuesto químico producido por una planta superior afecta negativamente a otro organismo.
Aleloquímico: Compuesto responsable del fenómeno aleloquímico.
Herbicida: Sustancia que destruye o inhibe el crecimiento de las plantas.
Hormona vegetal: Compuesto orgánico que se sintetiza en alguna parte de la planta y se transloca a otra parte, en donde a concentraciones muy bajas causan una respuesta fisiológica.
Mitocondria
(del griego mitos = hilo, hebra; chondros
= grano, terrón, cartílago): La usina celular. Organelas
autorreplicantes, que se encuentran en el citoplasma de la célula eucariota
rodeadas por membrana, completan el proceso de consumo de la glucosa
generando (por quimiósmosis) la mayor parte del
ATP que necesita la célula para sus funciones.
Organela celular, rodeada por una doble membrana, la
externa lisa y la interna rugosa con protuberancias denominadas crestas. La membrana celular interna rodea una matriz.
Muchas de las enzimas que controlan la respiración celular se encuentran en la
membrana interna y en la matriz.
Cloroplasto:
Organela celular rodeada por una doble membrana. En
el interior o estroma se
encuentra un sistema de membranas llamada tilacoides, que se
comunican frecuentemente formando pilas de sacos membranosos denominados granas. Las
enzimas que controlan la fotosíntesis se localizan sobre las membranas
tilacoides y en el estroma.
Membranas: Capas delgadas constituídas principalmente por lípidos y proteínas, que
separan las células de su entorno. Existen membranas en el interior de las
células que permiten la compartimentalización (p. ej. limitando las vacuolas y
las organelas).
Vegetales: La mayoría de las algas y todas las plantas verdes; los vegetales verdaderos mas importantes son los siguientes:
Algas cafés
Algas rojas
Algas verdes
Musgos y hepáticas
Plantas vasculares (o Superiores):
Helechos y afines
Cicadáceas y gimnospermas poco comunes
Coníferas (gimnospermas comunes)
Plantas con flores (angiospermas): Dicotiledóneas y Monocotiledóneas
Duke, S. O., Dayan, F. y Rimaudo, A. (1998), Proceedings of Special Lecture Meeting. (J. A. Hall Ed.), Tokio, p. 1-11.
Einhellig, F. A. (1995), en Allelopathy: organisms, processes and applications. (Inderjit, Darkshini y Einhellig Ed.), Vol 582, American Chemical Society, Washington, D.C., p. 1-24.
Einhellig, F. A. (1995), en Allelopathy: organisms, processes and applications. (Inderjit, Darkshini y Einhellig Ed.), Vol 582, American Chemical Society, Washington, D.C., p. 96- 116.
Devi, R. S., Pellissier F. y Prasad M. N. V. (1997), en Plant Ecophysiology, John Wiley & Sons, New York, p. 253-302.
Macías, F. A., Molinillo J. M. G., Galindo J. C. G., Valera R. M., Torres A. y Simonet A. M. (1999) en Biologically Active Natural Products: Agrochemicals. (H. G. Cutler y S. J. Cutler Eds), CRC Press, London, p 15-31.
Macías, F. A., Castellano, D. y Molinillo J. M. G. (2000), J. Agric. Food Chem., 48, p. 2512-2521.
Mandava, N. B. (1985), en The Chemistry of Allelopathy (A. C. Thompson Ed.), Vol 268, American Chemical Society, Washington, D. C., p. 33-54.
Muller, W. H. y Muller, C. H. (1964) Bull. Torrey Bot. Club. 91, 327-330.
Patterson, D. T. (1986), en Research Methods in Weed Science. (N. D. Camper Ed.), Vol. II, Southern Weed Science Society, Clemson, South Carolina, p. 111-134.
Reigosa, M. J., Souto C. y Gonzalez L. (1996) en Allelopathy: Field observations and Methodology.(S. S: Narval y P. Tauro Eds), Scientific Publishers, Jodhpur, p. 213-231.
Rice, E. L. (1984), Allelopathy, Academic Press, London.
Salisbury, F. B. y Ross C. W. (1994) Fisiología Vegetal, Editorial Iberoamerica, Méjico.
![]()
http://www.cenargen.embrapa.br/rec_gen/glossario/glossario.html
Plantas alelopáticas
http://www.webcolombia.com/alelopatia/principio%20Activo.htm
Alelopatía
en el manejo de malezas en citrus.
http://edis.ifas.ufl.edu/CH060
Alelopatía
de Lantana camara (Es muy bueno y didáctico. He leído muchos de los trabajos citados en esta revisión).
http://topaz.kenyon.edu/people/rineharta/allelo.htm
Estudios alelopáticos de
plantas superiores
http://www.uca.es/dept/quimica_organica/alelo.htm
THE
ALLELOPATHIC POTENTIAL OF APIACEAE SEEDS UPON GERMINATION OF LETTUCE
http://koning.ecsu.ctstateu.edu/research/allelopathy.html
MEMBERS OF INTERNATIONAL
ALLELOPATHY SOCIETY
http://www.uca.es/dept/quimica_organica/ias/lismemb.htm
Alelopatía
http://www.mdp.edu.ar/illia/Nueva/Aleopatias/Alelopatia%20-%20Historia.htm
REVISIÓN SOBRE LA ALELOPATÍA
DE Eucalyptus L´Herit
http://www.socbot.org.mx/publicaciones/boletin/bolres58e.html
Publicaciones de Sanidad
Vegetal
http://www.iicasaninet.net/pub/sanveg/
HORMONAS
NATURALES PARA CONTROL DE PLAGAS
http://aupec.univalle.edu.co/informes/septiembre97/boletin45/hormonas.html
EFEITO ALELOPÁTICO DE
LEGUMINOSAS UTILIZADAS COMO ADUBO VERDE
http://www.unimar.br/ciencias/5-9-1.html
ESTUDO QUÍMICO E ALELOPÁTICO PRELIMINARES DOS EXTRATOS ALCOÓLICOS DAS FOLHAS DE TIMBÓ (Ateleia glazioviana Baill.) SOBRE A GERMINAÇÃO DE SOJA (Glicyne max L.) E GORGA (Spergula arvensis L) http://www.sbq.org.br/ranteriores/23/resumos/0975/
RELACIONES QUÍMICAS: UNA
REVISIÓN A LAS ALELOSUBSTANCIAS NATURALES
http://www.mediterraneadeagroquimicos.es/Alel.htm
Dinámica y complejidad de
la competencia de malezas
http://www.fao.org/docrep/T1147S/t1147s07.htm
Identificación de un
compuesto alelopático de Baccharis boliviensis (Asteraceae) y
su efecto en la germinación de Trichocereus pasacana
(Cactaceae)
http://www.ots.ac.cr/rbt/revistas/48-1/botcazon.htm
ATIVIDADE POTENCIALMENTE
ALELOPÁTICA EM PLANTAS DE ACAPU (Vouacapoua americana Aublet).
I - EFEITOS DE EXTRATOS AQUOSOS DA CASCA
http://www.sbz.org.br/eventos/PortoAlegre/homepagesbz/
For%5CFOR106.htm
EFEITO DE ACETOFENONAS
4-SUBSTITUÍDAS SOBRE A GERMINAÇÃO E CRESCIMENTO DE LACTUCA SATIVA.
http://www.sbq.org.br/ranteriores/23/resumos/0757/
|
|