Hepadnaviruses (HBV)Steve Dewhurst, Associate Professor of Microbiology and
Immunology, University of Rochester Medical Center USA. Referencias: Ganem, D. Fields Virology, 3rd Edition, Chapter 85. GeneralidadesHBV es uno de los virus más importantes desde el punto de vista médico. Infecta a más de un cuarto de billón de personas y es una de las principales causas de cirrosis y cáncer hepático (carcinoma hepatocelular). HBV, también representa el primer ejemplo del éxito de una vacuna recombinante para una enfermedad contagiosa humana, y puede tener importantes implicaciones para otras enfermedades de transmisión sexual, como el HIV. Los hepadnavirus son un subgrupo de los virus que producen hepatitis. Los demás virus que causan hepatitis (sin relación alguna con los hepadnavirus ) son:
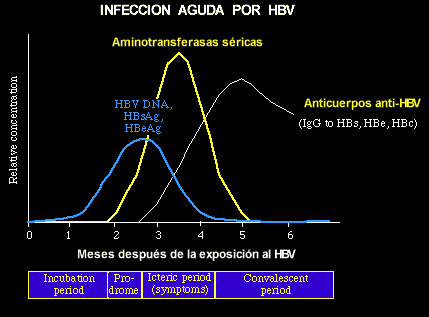
Clasificación de los hepadnavirusHBV: Biología y PatogeniaEpidemiologíaMás de 250 millones de personas están crónicamente infectadas con HBV (la mayor parte de los individuos viven en Asia y Africa; son el 5% de la población mundial). De estas personas, cerca del 25-40% morirán de cirrosis hepática ó de carcinoma hepatocelular primario. El virus se propaga por contacto sexual ó por los fluídos corporales, principalmente la sangre (drogadictos intravenosos, salones de tatuaje, pinchazos por agujas) y por transmisión vertical de la madre al bebé. Hay que resaltar que 1 ml de sangre de un portador de HBV contiene cerca de 10 billones de viriones infecciosos, y pueden seguir infecciosos después de secarse la sangre en las superficies por más de una semana. Resultando que el riesgo de adquirir HBV por un pinchazo de aguja es mucho mayor que el de adquirir HIV. En USA, hay alrededor de 1 millón de portadores de HBV, en 1993 se registraron 43,000 casos de hepatitis en la CDC ( CDC=Comunicable Disease Center, cerca de un tercio se debían al HBV), HBV está en el tercer puesto de las enfermedades de declaración obligatoria, detrás de las enfermedades venéreas (gonorrea y sífilis) y varicela. Patogenia de la infección por HBV Infección HBV aguda. Puede ser muy variable, la mayoría de las personas no muestran signos clínicos obvios de la infección. Manifestaciones típicas con ictericia aparecen en un 20-35 % de los casos; la enfermedad es menos severa en los niños y aún más si la dosis infecciosa es baja. La hepatitis fulminante es muy rara. A la infección inicial por HBV sigue un largo período de incubación 45-120 días. Durante este tiempo, el virus se replica intensamente (> 1010 partículas/ml). Al final del período de incubación, sigue una fase prodrómica breve (caracterizada por un cuadro clínico como el de la gripe, fiebre, fatiga, mal estado general). En algunas personas aparece una fase de ictericia (coloración amarilla de las mucosas, piel y conjuntiva). Esta fase puede prolongarse entre 4-8 semanas y es seguida por un período de convalecencia. La infección crónica activa por HBV tiene una incidencia del 2-10%, con mayor frecuencia en los niños (80-90% de la exposición neonatal al virus resulta en infección crónica). La mayoría de los enfermos crónicos están asintomáticos por muchos años, aunque hay evidencia bioquímica de daño hepático (transaminasas elevadas). La enfermedad como tal, puede tardar muchos años en desarrollarse (cuando lo hace) y puede producir una cirrosis ó un carcinoma hepatocelular. Los portadores siguen liberando grandes cantidades de virus y de HBsAg en su sangre y secreciones por muchos años. Un interrogante abierto a la investigación es: cómo y por qué, el resto de las personas expuestas al virus controlan la infección HBV aguda. y nunca se vuelven portadores. La evidencia disponible sugiere que este hecho puede relacionarse a la efectividad de la respuesta inmune celular, en particular a la respuesta citotóxica de linfocitos T (CTL). CTL está presente a niveles muy bajos en los portadores, apuntando a que esa escarcidad ó ausencia, predisponga a la infección crónica. Nota:: La infección neonatal de los bebés representa la puerta para la persistencia endémica de HBV, ya que la gran mayoría de las exposiciones neonatales acaban en infecciones crónicas.
Carcinoma hepatocelular (otros nombres: hepatoma, HCC ). Esta enfermedad mata 500,000 personas en todo el mundo cada año y cada año aparecen 5,000 nuevos casos en USA. El riesgo de padecer HCC en un período de 50 años es del 15% en los portadores de HBV (a menos que la cirrosis se desarrolle antes), y hay un riesgo 200 veces mayor para tener un HCC en las personas infectadas de HBV comparadas con las personas no expuestas. A título comparativo, fumar aumenta en 10 veces el riesgo de cáncer. Dinámica viral de la infección por HBV Ha sido estudiada recientemente en portadores (Nowak et al., PNAS USA 93:4398, 1996). La liberación total vírica en la periferia (sangre) es aproximadamente de 1011 viriones por día, y la vida media de las células infectadas por HBV es de 10-100 días. Este nivel de producción es 100 mayor que en el caso del HIV-1, tal vez en parte porque la vida media de las células infectadas por HBV es de 10-100 más larga que las células infectadas por HIV-1 Cálculos adicionales indican que, en promedio, en una infección crónica por HBV, se infectan (y producen virus) entre un 5-40% de hepatocitos (el hígado contiene cerca de 2 x 1011 hepatocitos). Alrededor de 1-10% de las células infectadas son destruídas cada día, lo que indica que el cuerpo tiene que fabricar 109 hepatocitos cada día, para mantener un equilibrio con la destrucción que existe. Control de la infección HBV VACUNACION. HBV es el único ejemplo del éxito de una vacuna en contra de un virus mucoso (ö sexualmente transmisible). Este hecho puede tener repercusiones, tal vez, en el control de la infección HIV. La vacuna original HBV fué fabricada a partir del HBsAg purificado del plasma sanguíneo. Esta vacuna plasma-derivada ya no se produce más en USA y ha sido reemplazada por la vacuna HBsAg recombinante derivada de las levaduras. Recomendaciones para la vacunación de HBV
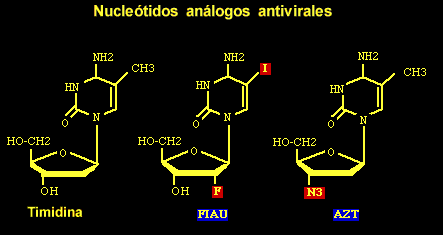
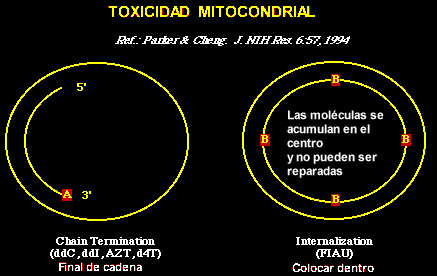
Inmunoprofilaxis post-exposición al virus Se recomienda tratamiento con HBIG ( HBIG = high-titered human Hepatitis B Immune Globulin = Inmunoglobulina contra la hepatitis B ). Esta inmunoglobulina contiene niveles altos de anticuerpos HBsAg y pueden ofrecer una protección pasiva contra HBV FARMACOS, OTROS TRATAMIENTOS Interferón-alfa. Es el único fármaco aprobado en US por la FDA para su uso en la lucha contra la HBV. Al parecer se asocia con una mejoría clínica en pacientes con infección HBV crónica, aunque no se sabe si el interferón es más ó menos efectivo que otros productos como el lamivudine.(Ver más adelante) Lamivudine (3TC). Es un análogo de los nucleósidos, un finalizador de cadena, el cual interfiere con la actividad de la transcriptasa inversa del HBV y del HIV-1. 3TC (3'-thiacitidina) ha demostrado recientemente poseer una fuerte actividad anti-HBV en individuos con hepatitis B crónica.(Dienstag et al. NEJM 333:1657, 1995). 3TC es un fármaco seguro y poco tóxico en comparación con otros análogos de los nucleósidos que han sido ensayados en contra de la HBV. (ver más abajo) FIAU Fialuridine.(fluoro-iodo-arabinofuranosil-uracil) es un análogo del nucleósido deoxythymidine (como el AZT), el cual pareció prometedor en contra del HBV in vitro. Pero, en 1993 un ensayo clínico controlado por la NIH, de 15 pacientes que recibieron FIAU, 5 murieron. Ellos desarrollaron una inesperada toxicidad mitocondrial, debido a que el FIAU se acumula en el ADN mitocondrial. Se cree que esto fué lo que pasó, porque FIAU a diferencia de AZT y 3TC no es un finalizador de cadena; y por eso puede acumularse en el ADN que se divide rápidamente. Transplante hepático. Puede ayudar a las personas con daño hepático grave, aunque la supervivencia al año es de solo el 50% en enfermos cirróticos HBV+ , en contraste con una supervivencia al año del 80% en enfermos HBV sin cirrosis. No se sabe si los fármacos antivirales pueden aumentar la supervivencia después del transplante. Además Thomas Starzl ha transplantado hígados de baboon a humanos, ya que el baboon es resistente al HBV. No está claro si es una estrategia segura y ampliamente aplicable, considerando la disponibilidad del animal y las infecciones emergentes que pueden desarrollarse a partir de estos xeno-injertos. (xeno:griego: xénos = extraño, de fuera, foráneo)
BIOLOGIA MOLECULAR DEL HBVCLASSIFICACION. La familia de los hepadnavirus incluye algunos virus no humanos parecidos al HBV, tienen propiedades comunes como la organización de su genoma y el modo de replicarse. En el ámbito biológico, estos virus se asocian con la hepatitis, cirrosis y neoplasias hepáticas, y todos son hepatotrópicos. Pueden ser persistentes y liberarse en grandes cantidades. Como familia, el hepadnavirus tiene una relación filogenética a : (1) virus del mosaico de la coliflor, y (2) a los retrovirus, con los que comparten el enzima de la transcriptasa inversa entre otras propiedades. Algunos ejemplos de los hepadnavirus no humanos son: WHV: virus de la hepatitis de la marmota (Woodchuck Hepatitis Virus); GSHV :virus de la hepatitis de la ardilla (Ground Squirrel Hepatitis Virus); DHBV: virus de la hepatitis del pato. (Duck Hepatitis B Virus). Los hepadnavirus aviares son únicos en la codificación de sólo 3 estructuras de lectura abiertas (S, C, P), mientras que el resto de los virus codifican además una estructura ORF (Open Read Frames) adicional, designada X. Partículas HBV. El virus HB produce varias partículas diferentes relacionadas con el virión, lo que es infrecuente en los demás virus. Entre ellas: (1) esferas de 42-47 nm. (conocidas como partículas de Dane, en honor de su descubridor); (2) esferas de 20 nm. (son 10,000 a 1,000,000 veces más abundantes que las partículas de Dane y (3) en menor cantidad filamentos de 20 nm. Todas estas partículas tienen un antígeno común: HBsAg : Antígeno de superficie del HB (Hepatitis B surface Antigen). Las partículas de Dane son las únicas infecciosas y contienen el núcleo viral y ácidos nucleicos virales. Las esferas más pequeñas y los filamentos contienen solamente HBsAg y algunos lípidos derivados de la célula huésped. (no contienen ácidos nucleicos virales). Es importante apuntar que aunque las esferas pequeñas y los filamentos no son infecciosos, son altamente inmunogénicos. De este modo actúan como señuelos durante la infección viral, absorbiendo los anticuerpos neutralizantes y evitando su acción sobre el antígeno HB (HBsAg). Genoma HBV. El genoma HBV es muy pequeño (3,2 kb). está compuesto de cadenas circulares , parcialmente duplicadas de ADN. La cadena -minus- de ADN viral (complementaria a la ARNm) es de un tamaño de 3,2 kb. La cadena -plus- de ADN viral es más corta y más variable en tamaño (1,8 a 2,7 kb), lo que significa que el genoma viral tiene solo parcialmente una doble cadena (parcialmente bicatenaria) .El solapamiento de los extremos 5´de las dos cadenas da forma circular al genoma. (Anotar que la polimerasa ADN del virión repara, precozmente en el proceso de replicación viral, la brecha en el genoma y crea un duplicado con un genoma circular mellado). El genoma viral es compacto y contiene 4 ORFs ( Overlapping open Reading Frames = estructuras de lectura abiertas y sobrepuestas) en la cadena -minus-, lo que permite al genoma viral codificar 50% más información que haciéndolo de otro modo. Además, y algo inusual, todos los elementos activos -cis- que controlan la expresión genética viral están integrados en al menos una de las ORFs (Ej: serán traducidas las secuencias que corresponden a los promotores y cooperantes virales). Los ORFs virales son:
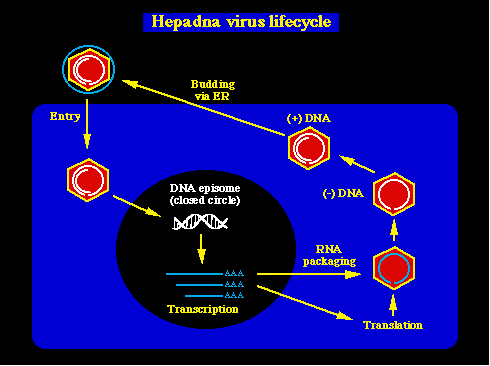
Para mayor complejidad. La organización de los genes que codifican HBcAg y la HBsAg son complejos. S ORF. El producto de la S ORF (Proteína S, también llamada: ABsAg) es 24 kD, pero formas mayores pueden hacerse debido al uso de dos codones de arranque, dentro de la estructura y contracorriente (estos codones de iniciación corresponden a los pre-S1 y pre S-2 ORFs). El más largo de estos, llamado proteína pre-S, es la Proteína-L 39-kD, la cual es el producto inicial del primer AUG de la ORF. Las demás proteínas pre-S son: la Proteína M 31 kD. Las proteínas S, M, L, comparten el mismo C terminal y difieren solamente en el N terminal. Las proteínas se fabrican aproximadamente en las proporciones 100:10:2 . Interesantemente, las partículas no infecciosas del HBV contienen principalmente proteína S, algo de proteína M y ninguna proteína L. Sin embargo las partículas de Dane, las infecciosas, son ricas en proteínas L. estos resultados son consistentes con la idea de que la proteína L puede ser importante en el ensamblaje viral y en su infectividad, tal vez porque puede unirse a los receptores celulares para el HBV C ORF. Como en la S ORF, existen dos codones AUG de arranque dentro de la estructura .La clásica HBcAg (22kD) se hace usando el AUG interno. Una segunda proteína se hace usando el AUG contracorriente. esta proteína se procesa después de su traducción para producir HBeAg (16kD). La HBeAg no se incorpora en los viriones, pero se segrega al suero. Su función no es clara y no es necesaria para la replicación viral in vitro. Una posibilidad es que la HBeAg pueda actuar como una proteína cooperante al aumentar la tolerancia neonatal y así colaborar en el desarrollo de la infección crónica en el proceso de la transmisión vertical del virus. Debe tenerse en cuenta que un nivel alto de HBeAg en suero está relacionado con una mayor capacidad infecciosa de un portador HBV CICLO VITAL DEL HBV
GENERALIDADES Los eventos iniciales (adhesión, entrada) no se acaban de entender bien y se desconoce el receptor celular para el HBV. Después de la entrada del virión, la partícula del núcleo viral es trasladada al núcleo de la célula, el ADN viral es reparado y madurado, dando lugar a un ADN circular, cerrado por enlaces covalentes (ADNccc; covalently closed circular DNA cccDNA). El ADNccc puede ser considerado como análogo al ADN proviral formado por los retrovirus, excepto que el ADNccc del HBV permanece por fuera y normalmente no se integra. El ADNccc sirve como una plantilla para la polimerasa II del ARN de la célula, y esto da lugar a la producción de ARNm viral. Sirviendo la más grande de éstas últimas moléculas como ARNm y como ARN (pre)genómica (ARNpg). La ARNpg es un poquito mayor que el tamaño genómico y está almacenada en partículas virales. Expresión genética del HBV Elementos reguladores que actúan en forma cis. Hay 4 copias virales principales, las cuales no están entrelazadas y terminan a la vez en un sitio común: poli-A Cada copia es controlada por un regulador específico , y a los 4 reguladores genómicos virales se les conoce como: pre-S1, S y X . Además, hay 2 amplificadores, que contribuyen a que los reguladores: genómico (EnII) y X (EnI) se exprese de modo específico en el hígado. Proteína viral que actúa en forma trans. La proteína X del HBV es un activador trans muy potente de muchos genes, incluyendo los genes virales. Pero no afecta al ADN, por lo que debe hacer la copia indirectamente. La función biológica de la proteína X y su función en el ciclo vital del virus, permanece oscura, aunque se ha demostrado que es necesaria para que la infección tenga lugar en los animales. (la supresión del gen X, en el virus de la hepatitis de la marmota, convierte al virus en inofensivo). Procesamiento del ARN. Un problema interesante en la transcripción del HBV es el hecho de que el ARN genómico, tiene un exceso en su parte terminal con dos copias de la señal poliA (poliadenilación). Una está cerca del final 5' de la transcripción (y es ignorado), mientras que la otra está al final 3' de la transcripción (y es obedecida).Es muy parecido a lo que ocurre en los retrovirus, donde la señal poliA en 5'-LTR es ignorada, mientras que la señal poliA en el 3'-LTR es obedecida. El mecanismo que hace que una señal poliA sea ignorada, se desconoce, aunque se ha sugerido que la causa sea la proximidad del sitio de la 5'-poliA al 5'-final del ARNm. Replicación del genoma HBV. Polimerasa viral. La ORF P codifica la polimerasa viral, la cual tiene la transcriptasa inversa y posee funciones RNasaH, como el producto genético pol retroviral. A diferencia del pol, la P NO tiene actividad integrasa ó proteasa. Este hecho no es sorprendente, ya que el HBV no se integra en los cromosomas del huésped y porque el HBV no efectúa la maduración proteolítica de sus proteínas. Existen otras dos importantes diferencias entre la proteína HBV-P y los productos génicos pol del retrovirus, 1-la proteína HBV-P no necesita ser proteolíticamente procesada para que se active su propiedad enzimática y 2- la proteína P por sí misma actúa como el catalizador para la cadena -minus- de la síntesis de ADN. La HBV-P se une específicamente al
stem-loop
( Hay que resaltar que la unión forzosa de P al elemento (épsilon) es un mecanismo de seguridad, porque si fuera de otra manera, la actividad de la transcriptasa inversa en el citoplasma pudiese resultar en ua copia indiscriminada del ARNm y en la producción de cadenas simples de ADNc. Estas cadenas simples de ADNc podrían tener un alto poder recombinante y con posibilidades de integrarse en el cromosoma, probablemente destruyendo la célula huésped. (ver Tavis and Ganem, J. Virol. 70:5741, 1996). Doble función del elemento Síntesis del ADN del HBV. El siguiente paso en el ciclo vital del HBV es la síntesis del ADN:
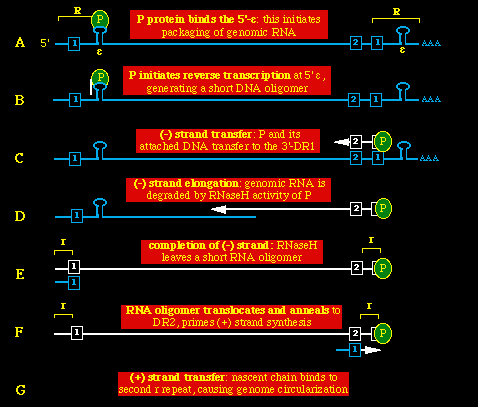
Síntesis del ADN del HBVAdaptado de Ganem, Fields Virology 3rd Edition, Chapter 85
Esquema: R es un repetidor terminal de gran tamaño, presente en ambas porciones terminales del genoma del ARN: r es un repetidor terminal de tamaño pequeño situado en las porciones terminales del genoma del ADN; 1 , 2 son repetidores directos idénticos y frecuentes localizados en el terminal del genoma. Sumario de la síntesis del ADN del HBV. Las características más importantes son:
Relaciones con la replicación viral. El HBV tiene un modo infrecuente de replicación, similar al de otros retrovirus y en particular a los spumavirus. Algunas diferencias son:
HBV y Carcinoma Hepatocellular (HCC)Hay una fuerte evidencia epidemiológica que establece una relación entre el HBV y el HCC, entre otros:
Modelos para la oncogénesis del HBV.Existen dos modelos básicos para explicar la función del HBV en la HCC
Los cofactores pueden también contribuir al desarrollo del HCC. La aflatoxina encontrada en algunos alimentos, es uno de esos cofactores en algunas áreas geográficas. Por otra parte puede ocurrir una mutación de un gen celular, como el gene supresor tumoral p53. ( un punto caliente mutacional en el codón 249 del p53 ha sido detectado en varios hepatomas ).
Actualizado 1/97, Steve Dewhurst, Associate Professor of Microbiology
and Immunology URL: http://www.urmc.rochester.edu/smd/mbi/grad2/hbv97.html |