Replicación viral y antiviralesSteve Dewhurst, Associate Professor of Microbiology and
Immunology, University of Rochester Medical Center USA. Barra de exploración VOLVER AL PORTAL ( http://fai.unne.edu.ar/biologia) Conceptos básicosLos virus utilizan la maquinaria celular para la replicación y síntesis de sus ácidos nucleicos y la transcripción de la información genética. Por eso, cualquier inhibidor de la replicación viral puede también afectar a la célula, ser citotóxica y causar su muerte Algunos virus codifican los enzimas relacionados con los procesos de replicación, por ejemplo: los virus del herpes I y II, el varicela zóster y el citomegalovirus (CMV), todos codifican su propia ADN polimerasa, y todos los virus ARN codifican su polimerasa ARN; excepto los retrovirus, los cuales poseen la transcriptasa inversa, la cual transcribe el ARN para producir su ADN y actúa también como una polimerasa ADN. Replicación de los virus ADNLa mayoría de los virus ADN codifican su propia polimerasa ADN, excepto los virus ADN pequeños, como los parvovirus, papillomavirus. Esta diferencia, significa que los virus ADN pequeños necesitan células huésped en fase mitótica para suministrarles la ADN polimerasa celular (un hecho importante en la patogenésis del HPV y de los parvo-B19). Hay 3 maneras en que los virus ADN replican su material genético:
EJEMPLOS DE DOS MODOS DE REPLICACIÓN DE ADN: Papovavirus: Los papovavius como el SV40 y los papilomavirus humanos son círculos ds-ADN, los cuales se replican usando un origen específico de la replicación ADN (ori), el cual sirve como un punto de arranque para la replicación bidireccional del ADN. Intermediarios de la replicación con la forma theta pueden ser visualizados por medio del microcospio electrónico.
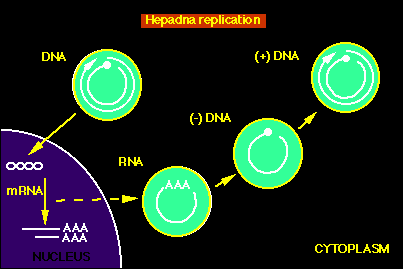
Virus de la Hepatitis B: El HBV es único entre los virus ADN, debido que usa un intermediario ARN para su replicación. El genoma del virión es una doble cadena incompleta de ADN, y la primera cosa que hace es completarla. La cadena negativa es así transcrita a ARN y éste a su vez produce una cadena complementaria de ADN. La doble cadena parcial de ADN del virión es de éste modo sntetizada. La replicación de ADN se hace por medio de la transcriptasa inversa/polimerasa del virus Replicación de los virus a ARN
Los virus ARN tienen muchos modos de replicarse. En la siguiente figura se hace un resumen gráfico de las estrategias usadas por los virus ARN, la información es la misma que en la tabla anterior, solo que la información se representa en un formato diferente.
Hay que recordar 3 puntos importantes acerca de los virus ARN:
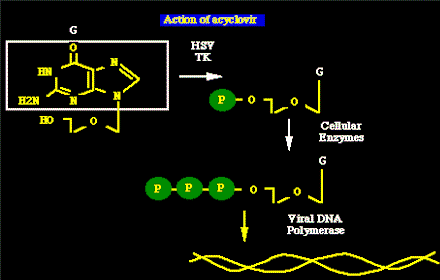
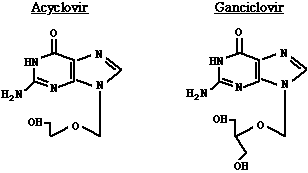
Fármacos antiviralesA continuación, una lista de los antivirales más útiles en la clínica. El único fármaco, cuyo modo de actuar no es la inhibición de la replicación del genoma, es la amantadina/rimantidine, la cual inhibe la destrucción de la envoltura del virus de la influenza A en los endosomas celulares. Aciclovir y Ganciclovir: Son análogos de la guanosina y tienen diferentes grados de eficacia en contra de los herpesvirus. Aciclovir (ACV) es activo en contra el virus del herpes simplex (HSV) y el virus del varicela-zóster (VZV), mientras que el ganciclovir es más activo en contra del citomegalovirus (CMV). Ambos fármacos están fosforilados y se incorporan en la cadena de ADN durante la elongación de la cadena. El aciclovir requiere la timidina cinasa (TK) del HSV ó del VZV para una fosforilación inicial eficiente. Después de este paso tan importante, el monofosfato es convertido a trifosfato de aciclovir por las cinasas celulares. El trifosfato es incorporado en el ADN viral por la acción de la polimerasa viral, más eficiente que la polimerasa celular. La base incorporada que carece de ribosa (a diferencia de su homóloga normal) previene así la elongación de la cadena. Por lo cual Aciclovir actúa a dos niveles y es un mejor substrato para los enzimas virales que los enzimas celulares, y de ahí su baja toxicidad. Nota: famciclovir está relacionado con el aciclovir y puede tener algunas propiedades mejoradas. Ganciclovir es más tóxico que aciclovir y actúa de un modo similar. Es más efectivo en contra del citomegalovirus (no tiene el gen de la TK). Parece que el ganciclovir es inicialmente fosforilado por el producto génico UL97 del CMV (una cinasa viral, también la tiene el HHV-6) y después es convertido en trifosfato de ganciclovir por los enzimas celulares. Nota: estudios recientes (Spector et al., NEJM 334:1491, 1996) sugieren que la administración profiláctica de Ganciclovir oral puede reducir el riesgo de CMV en las personas con SIDA: también es útil en los transplantados.
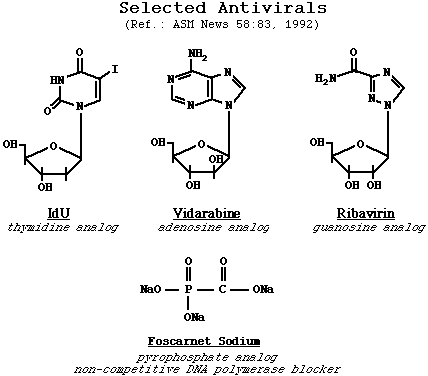
Cidofovir: Cidofovir [(S)-1-(3-hidroxy-2-phosphonylmethoxypropyl)citosina] es uno de los tres fármacos (con el ganciclovir y el foscarnet) aprobados para el tratamiento de la patología relacionada con el CMV. Es el primer análogo de un nucleótido (como el análogo nucleósido monofosfato) disponible para uso clínico. Es muy activo en contra del CMV, y al contrario que el ganciclovir, no requiere una fosforilación inicial por la cinasa viral (el producto genético UL97); requiere solamente ser difosforilado por las cinasas celulares. Vidaradina (ara A): Es un análogo de la purina con actividad en contra del grupo de los herpesvirus (HSV y VZV). Iinhibe la síntesis del ADN viral en concentraciones menores que las que se necesitan para inhibir la síntesis del ADN celular, pero es más tóxico que el aciclovir y el ganciclovir. En los casos donde el HSV es resistente al aciclovir por mutación del gen TK ó por la polimerasa viral. Actúa por la incorporación selectiva en el ADN viral e inhibición subsecuente de la elongación de la cadena de ADN. Ribavirin: Es un análogo de la purina y se parece a la guanosina. Su espectro antiviral comprende los virus ADN y los virus ARN como el virus respiratorio sincitial (RSV) y los virus de influenza A y B, y también los virus de la fiebre hemorrágica como la fiebre de Lassa y el virus de Hantaan. En USA, está legalizado su uso en contra del RSV. Actúa disminuyendo los depósitos de trifosfato de guanosina (GTP), inhibiendo la capa de protección del ARNm e inhibe la elongación del ADN y ARN. Foscarnet: Foscarnet (phosphonoformate),es uno de los tres fármacos, junto con el ganciclovir y el cidofovir, que han sido aprobados para el tratamiento de patologías asociadas al HSV y al CMV. Es un inhibidor no competitivo de la ADN polimerasa, es un análogo tipo pirofosfato (NO ES un análogo de un nucleótido y NO requiere activación intracelular). Es poco soluble y es potencialmente nefrotóxico.
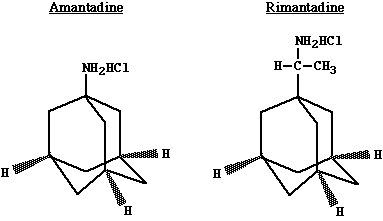
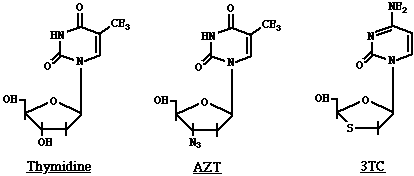
Amantadine/Rimantadine: Su modo de acción es inhibir la destrucción de la envoltura viral en los endosomas celulares. Actúa en la proteína M2 del virus de influenza A, e inhibe su habilidad para disminuir el pH del habitat del endosoma, esencial para destruír la envoltura viral y liberar la nucleocápside. Fármacos activos en contra del VHI-1: Zidovudine (AZT): Mecanismo de acción de zidovudine (3'-azido-3'-deoxythymidine) en la replicación del VHI-1: es un análogo sintético de la pirimidina e inhibe los retrovirus de los animales y de los mamíferos (HTLV-1 y VHI). El AZT es convertido en trifosfato por la fosforilación hecha por los enzimas celulares y así el AZT-TP es incorporado en la cadena nueva de ADN, inhibiendo su elongación (ya que no tiene los radicales -OH en la posición 3' ). El blanco del AZT TP es la transcriptasa inversa, que usa el AZT TP en lugar de la molécula habitual timidina trifosfato. El virus VHI puede volverse resistente a los efectos de la AZT, debido a las mutaciones que afectan a la estructura de la transcriptasa inversa (incluyendo cambios en los sitios activos del enzima).
Lamivudina (3TC), Didanosina(ddI), Zalcitabina (ddC), Stavudina (d4T): Tienen mecanismos de acción similares al AZt. 3TC = 2'-deoxy-3'-thiacytidine; ddI: 2',3'-dideoxyinosina; ddC: 2',3'-dideoxycytidina; d4T: 2',3'-didehydro-3'-deoxythymidina. Estos son análogos dideoxynucleosidos del dC, dA, dC, y dT respectivamente.
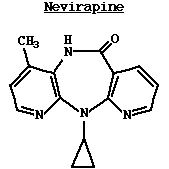
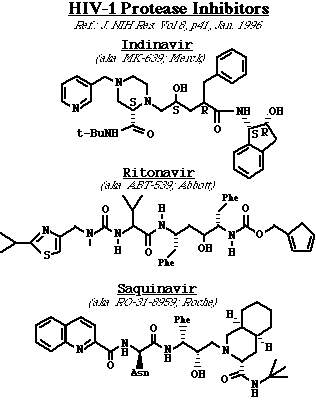
Nevirapine: Es un inhibidor no nucleósido de la trascriptasa inversa (RT). A diferencia de los análogos de los nucleótidos, para ser activa no necesita de una fosforilación, su acción es unirse a la RT e inactivar el enzima de una manera no competitiva. La nevirapina se une directamente a un hueco de 3 dimensiones cerca del sitio activo dentro de la molécula del enzima de la RT. Inhibidores de la proteasa del VHI. La VHI PR es un dímero simétrico, que contiene residuos apareados de ácido aspártico en su sitio activo. El complejo enzima-substrato también contiene una molécula de agua muy importante, única en las proteasas retrovirales, comparada con otras proteasas de ácido aspártico. La mayoría de los inhibidores enzimáticos son compuestos que imitan a los péptidos que son análogos de estados de transición. En otras palabras, dichos compuestos imitan la configuración del estado transicional del substrato natural del VHI PR Como consecuencia, los inhibidores se unen al enzima más fuertemente que el substrato natural (ya que el substrato debe distorsionarse para asumir la configuración de estado de transición). Estos compuestos son por lo tanto, inhibidores enzimáticos competitivos, y se clasifican de acuerdo a la simetría de sus estructuras. Así, el inhibidor de Merck, Indinavir y el inhibidor de Roche, saquinavir son asimétricos, mientras que el ritonavir de Abbot es muy simétrico. En general, los inhibidores de la proteasa han mostrado una gran promesa como fármacos anti VHI, particularmente cuando se usan en combinación con otros fármacos anti-retrovirales. Los problemas presentados con los inhibidores de la proteasa incluyen (1):mala absorción por vía oral (solo una pequeña fracción ingerida, pasa al torrente circulatorio), y (2): cruzan muy mal la barrera hemato-encefálica y por ende muy bajas concentraciones en el tejido cerebral.
Inhibidores de la proteasa del VHI, imágenes Terapia combinada. La terapia combinada ó el uso simultáneo de múltiples fármacos antivirales anti-VHI, puede ser el medio más efectivo de controlar la infección por VHI (por ejemplo: AZT + 3TC + indinavir es una combinación efectiva, tanto como otras combinaciones). Nota importante: en la clínica diaria se han descrito mutantes del VHI-1 resistentes a todos los fármacos descritos en esta hoja. La resistencia viral es un problema muy importante en los tratamientos antivirales. Actualizado el 3/98, Steve Dewhurst, Associate Professor of
Microbiology and Immunology URL: http://www.urmc.rochester.edu/smd/mbi/med/lec2.html |