Introducción a la Virología
|
Virus de la Hepatitis Delta (HDV)
Steve Dewhurst, Associate Professor of Microbiology and
Immunology, University of Rochester Medical Center USA.
Traducido por Néstor Núñez Acevedo MD. Gyn&Obst. Málaga. España
Referencias: Taylor JM, Fields Virology, 3rd Edition, Ch. 87; Taylor
JM, Semin. Virol. 4:313-317, 199
Barra de exploración
[ Principal ] [ Arriba ] [ Clasificacion de virus ] [ Clasificacion virus hepatitis ] [ Hepadnavirus ] [ Hepatitis delta ] [ herpesvirus 1 ] [ Herpesvirus 2 ] [ Biologia molecular del sida ] [ biologia viral 1 ] [ VIH ] [ Paramyxovirus ] [ Virus herpes ] [ inhibidores de la proteasa ] [ Rhadboviruses ] [ Vacunas ] [ Glosario ] [ Virología ] [ Replicacion y antivirales ] [ Virus respiratorios ] [ Virus SNC y GI ] [ Virologia 7: Virus Tumorales ] [ Virus herpes 2 ] [ caso 2 ]
Generalidades:
El HDV es un: ¡ parásito de un parásito!
Específicamente necesita al HBV para replicarse, pero es genéticamente
diferente al HBV. Así el HDV es un satélite subviral del
HBV.
HDV es ( hasta ahora) único entre todos los virus conocidos, y representa el único
miembro de un género viral designado recientemente: Deltavirus.
HDV, por consiguiente tiene similitudes importantes
con los viroides.
Viroides: son pequeñas moléculas de ARN
sin envoltura que pueden producir infecciones en las plantas. Tienen una estructura ARN
similar al HDV (ambos forman bastones de ARN ) y poseen actividad
riboenzimatica
(enzima ARN) parecida a la del ARN del HDV, incluyendo funciones como la de división y
anudación por si misma del ARN. Los viroides son mucho más pequeños que el HDV (<
400 nt ) y no codifican proteínas. En contraste, el HDV tiene un genoma de 1,700 nt y
codifica una sola proteína, el antígeno de la hepatitis delta. HDAg
Recientemente se ha identificado un homólogo celular del
HDAg, lo que sugiere que el HDV puede haber evolucionado de un viroide
ARN, por medio de la captura de una copia celular.(Brazas and Ganem, Science 274:90,
1996).
Ciclo vital y biología del virus.
Virion. Todas las
proteínas de la superficie del HDV son derivadas del HBV, e incluyen las formas S-, M-, y
L- de la HBsAg. Esta envoltura prestada del HBV rodea la nucleocápside con el núcleo,
que contiene el genoma HDV (una cadena simple de ARN de 1,7 kb) junto con cerca de 60
copias de los antígenos delta grandes y pequeños. ( Ag-L y Ag-L y  Ag-S; otros nombres: LHDAg y SHDAg). Ag-S; otros nombres: LHDAg y SHDAg).
Genoma viral
El genoma HDV tiene varias propiedades importantes e inusuales, como:
- Tiene un genoma circular ARN de
cadena simple.
- El genoma tiene un tamaño de 1700 bp. Por lo que es el
virus animal más pequeño que se conoce.
- El genoma ARN se dobla sobre sí mismo, y forma una estructura sin ramificar estable y cilíndrica. Cerca del 70% de las bases
del genoma están en pares (presumiblemente, el resto permanecen impares para prevenir la
eficiente inducción del interferón)
- El ARN del genoma y su complemento, el antigenoma, pueden funcionar como un riboenzima (ó cuerpo con
propiedades enzimáticas) para efectuar las reacciones de partición y encadenamiento
de sí misma. Ver más abajo.
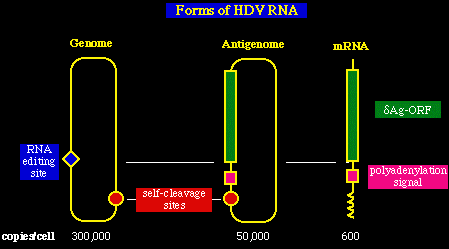
El ARNs viral dentro de la célula infectada.
Cada célula infectada con HDV contiene 300,000 copias del ARN genómico
viral, además existen otros 2 ARNs presentes. El primero de éstos ARNs es complementario
al ARN genómico viral y se le conoce como el antigenoma
(50,000 copias por célula). El segundo es un ARN mensajero poliadenilado de 800 bp (600
copias por célula), el cual codifica el antígeno delta ( Ag ó HDAg)..
Es la única proteína que codifica el HDV (resaltar que se hacen dos
formas de HDAg, una forma corta y otra larga; ver más abajo) Ag ó HDAg)..
Es la única proteína que codifica el HDV (resaltar que se hacen dos
formas de HDAg, una forma corta y otra larga; ver más abajo)
|
 |
Los dos ARN, el genómico y el antigenómico se enrollan formando estructuras
cilíndricas, y ambas pueden funcionar como riboenzimas.
Específicamente, cada ARN tiene un sitio único donde puede ocurrir la auto división.
Estos sitios de partición ó división corresponden a regiones del ARN viral que forma
una estructura de 4 ramas ó ejes conocido como falso nudo. Estructuras similares se
encuentran en los riboenzimas con
forma de - cabeza de martillo- y con forma de - U - de los patógenos
subvirales de las plantas, y estos riboenzimas
pueden dividirse en dos dominios: un sitio activo (el enzima) y el substrato (el sitio de
división). Anotar que el ARN genómico y antigenómico
pueden a su vez tener reacciones de auto-encadenamiento en el mismo sitio en que empieza
la partición.
DEFINICION: Se forma un falso nudo cuando la
región del asa de una cadena simple forma pares de bases tipo Watson-Crick con una
región complementaria fuera del asa.
Anotar que la actividad de auto-partición en el ARN del HDV es una actividad
potencialmente letal que debe ser
inhibida durante la mayor parte del ciclo vital del virus. En efecto, apareamientos en
forma de cilindro (ó bastón) aparecen entre las secuencias
del riboenzima y el así llamado: secuencias del atenuador en el genoma viral. Este proceso previene al genoma viral de
partirse el mismo en dos. Durante la replicación viral, los factores específicos
del huésped (ó chaperones ARN ) activan los riboenzimas,
evitando su unión con las secuencias del atenuador;
y de esta manera activan el riboenzima durante la replicación.
Estadíos del ciclo vital del HDV.
La entrada en el huésped es mediada por sustancias derivadas de la envoltura del HBV.
El genoma viral ARN es duplicado por el ARN y llevado al núcleo de la
célula, un proceso controlado por la polimerasa II del
ARN del huésped. De alguna manera la polimerasa II es reorientada
para usar una plantilla de ARN, aunque no está claro el cómo (este proceso no parece
depender del HDAg, y puede en cambio depender de la estructura del ARN viral).
Hay que reseñar que la forma corta del antígeno
delta, SHDAg, es necesaria para la replicación del genoma, mientras que la forma larga
del antígeno la inhibe la replicación del genoma. Pero, la función precisa de las dos
proteínas es todavía poco conocida.
Síntesis ARN del HDV
La síntesis del ARN del HDV parece seguir el siguiente camino:
- La transcripción del ARN genómico empieza en un único loci cerca del tope de la
estructura cilíndrica (A).
- El ARN recién sintetizado es procesado por poliadenilación para liberar ARNm viral.
- El ARNm viral codifica el antígeno delta (B).
- El duplicado en crecimiento sufre una auto-división, y la transcripción sigue
alrededor del genoma viral.
- En este paso se suprime la señal de poliadenilación
(C).
- El mecanismo por el cual se suprime la señal de poliadenilación puede ser debido
a:
- La estructura de esta especie larga de ARN (como cilindros ó bastones, diferente a la
plantilla inicial)
- La actividad del HDAg, la cual puede unirse al ARN cilíndrico suprimiendo la
poliadenilación.
- La síntesis del ARN continúa y el elongado ati-genoma de ARN sufre una segunda
partición (D), seguida de
- Auto reparación (E) para generar un
anti-genoma ARN, intacto, circular y cerrado.
- Este anti-genoma vuelve a ser transcrito para generar nuevos genomas ARNs.
Recalcar que no existe un loci poliA en el antigenoma que afecte al proceso de la
elongación del ARN. Así, el antigenoma es duplicado por un mecanismo
giratorio circular, con unidades individuales del genoma que son
liberadas por autolisis.
Traducción
El HDV produce solo una única especie de ARNm, pero codifica dos formas diferentes del
antígeno delta. Se debe a un evento específico de edición
del ARN después de la transcripción, que permite al virus hacer dos proteínas partiendo
del mismo ARNm. Específicamente, un UAG-stop al final de los 195 aminoácidos; SHDAg se
transforma en un codón triptófano-UCG, por la incorporación del triptófano en la
proteína y de 19 aminoácidos C-terminales, dando lugar a la forma 214 aa del HDAg (LHDAg)
Ambas de las formas del HDAg se unen al ARN, y ambas contienen (i) una región
espiroidal en espiral que es importante para las interacciones proteína-proteína y
también como (ii) una señal de localización nuclear. Naturalmente, las proteínas
también tienen importantes diferencias funcionales. La SHDAg se
requiere para la replicación, mientras que la forma grande es un potente
inhibidor trans-dominante de la
replicación. Por otra parte, solamente la LHDAg está empaquetada dentro de los viriones
y solamente la LHDAg es requerida para el ensamblaje
viral.
El requisito para la presencia del LHDAg en el ensamblaje viral puede estar relacionada
en parte a su habilidad para ser modificada después de ser transcrita. Específicamente,
los últimos 4 residuos en el C-terminal del LHDAg are Cys-XXX. Este complejo corresponde
a un loci en el cual los lípidos de cadena larga se añaden a las proteínas, un proceso
conocido como prenilación (prenylation.) Lo que resulta en poner a las proteínas como blancos en la
membrana celular,
se piensa entonces que la prenilación pone como blanco a la LHDAg (mas la molécula
asociada ARN HDV) en la membrana plasmática, la cual contiene HBSAg. Además, la
prenilación también induce cambios adaptativos en la LHDAg y pueda alterar su actividad
biológica y funcional. Señalar que, aunque la prenilación es necesaria por la habilidad de la
LHDAg para dirigir el ensamblaje de partículas, no es suficiente para hacerlo así. Lo
que sugiere que la LHDAg tiene otras propiedades estructurales que pueden contribuir
a su función.
Conmutador SHDAg a LHDAg. Durante la
replicación HDV, los genomas S (codifican SHDAg) mutan en genomas L (codifican LHDAg).
Esta mutación (UAG ->UGG) dispara el conmutador que pasa de la replicación viral a la
morfogénesis y enpaquetamiento del virión, y es un paso en el ciclo vital del virus que
depende de un loci específico de la edición del ARN.
Mecanismo de edición del ARN. El
loci específico de la reacción de edición en el HDV depende de la habilidad del ARN
viral para formar una estructura parecida a un cilindro (ó bastón) en la región de
posición 1102 (el loci que es editado). Así, la estructura
secundaria ARN juega un papel crítico en la edición del ARN.
Además, el ARNs HDV muta aunque, in vitro, sean añadidos a extractos nucleares. Lo que
indica que la mutación se debe a una modificación del
ARN, justo después de la síntesis del ARN, y que no es el resultado
de una incorporación defectuosa durante la síntesis del ARN.
Estudios recientes han demostrado que la edición del ARN en el HDV ocurre solamente en
el antigenoma y comprende la conversión de una adenosina (A) en una inosina (I). esta
conversión de (A) a (I) es ejecutada por
un enzima conocida como ARN bicatenario
adenosín-deaminasa (dsRAD). La importancia de este cambio es
que la inosina (I), como la guanosina (G), prefiere hacer un par base con Citosina (C). El
resultado es que la maquinaria transcriptora de la célula toma a la Inosina como si fuera
Guanosina.
La deaminación oxidativa, catalizada ya sea por la dsRAD ó por un enzima conocido
como RED1, ha sido demostrado que ocurre también en el ARN celular. El ejemplo mejor
estudiado de este tipo de edición de ARN es la edición de ARNm el cual codifica ciertas
sub-unidades del receptor glutamato;
una molécula que interviene en la respuesta de las neuronas al neurotransmisor
estimulante, glutamato.
Ensamblaje del HDV e interacción con el HBV.
El ensamblaje del HDV requiere el uso de las proteínas de la envoltura del HBV ó de otro
virus de la familia hepadnavirus, también es requerida
la LHDAg para formar las partículas infecciosas HDV. En contraste,
el SHDAg no es necesaria para la
formación de partículas infecciosas HDV, aun cuando el SHDAg está de hecho presente
dentro de las partículas HDV (se cree que la unión de
la SHDAg al ARN del HDV resulta en el enpaquetamiento simultáneo de ARN HDV y de SHDAg
dentro de las partículas viral).
Patogenia y relevancia médica.
Generalidad. Como la HBV, la HDV puede producir
en los humanos infecciones agudas y crónicas. Es importante, desde el puntos de
vista médico, ya que la mortalidad de la infección por HDV está entre el 2 y el 20%,
una cifra que es 10 veces mayor que la del HBV.
Infección aguda por el HDV. Puede
ocurrir: (1) al mismo tiempo que una infección aguda de HBV ó (2) puede pasar en
personas ya infectadas con el HBV (superinfección con
HDV). En cualquier caso, la infección aguda por HDV es más severa
que las demás hepatitis agudas virales.
Como en la infección aguda por HBV, hay un tiempo
variable de incubación, que puede ser entre 3 a 7 semanas. Durante
éste período, la replicación viral es intensa y la carga de ARN viral en la sangre
puede alcanzar los 1 x 1012 genomas/ml de sangre. Después, viene la
fase prodrómica, con fatiga, náuseas y
síntomas parecidos a la gripe, que puede durar una semana. A veces le sigue una
fase ictérica y le sigue después la convalecencia.
Hepatitis viral fulminante, es una forma
muy severa y a veces letal de hepatitis aguda, es 10 veces más frecuente que en otros
tipos de hepatitis.
Cuando hay infección simultánea por HBV y HDV, el tiempo de incubación es mucho más
largo y acaba en una infección crónica en el 1-3% de los casos. La
superinfección por HDV es usualmente más grave y termina en una infección crónica en
el 70% de las veces.
Infección crónica por HDV. Es frecuente
en personas infectadas por el HDV. Cerca del 60-70% de los individuos con infección HDV
crónica desarrollan cirrosis; con una frecuencia tres
veces mayor que la que ocurre en las infecciones por HBV
ó por HCV
Tratamiento. No hay un tratamiento
efectivo para la HDV:
- Interferón alfa puede tener un efecto benéfico, en cuanto reduce los síntomas de la
enfermedad.
- Transplante hepático, se ha usado.
- Vacunas: La inmuninización en contra de la HBV da protección completa en contra del
HDV, ya que el HDV necesita del HBV para replicarse.
Epidemiología: El HDV es trasmitido
principalmente por la sangre,(infecta principalmente a los drogadictos
intravenosos). El HDV es mucho menos frecuente que el HIV-1, lo cual apunta a que no se
propaga por vía sexual. En USA, cerca de 70,000 personas padecen una hepatitis delta
crónica y causa unas 1,000 muertes por año
Modelos animales: Chipancés HBV+ pueden
ser infectados con HDV, y el HDV puede encontrarse en algunos animales. (Por ejemplo,
puede acompañar al virus de la hepatitis de la marmota).
Uso potencial del HDV como un vector
El alto número de copia del ARN del HDV (hasta el 20% del total ARN de la célula)
hace que el HDV sea un candidato atractivo para usarlo como un vehículo de trasnporte
génico al hepatocito, por ejemplo, para la inhibición de la infección HBV. A
continuación describo 3 posibilidades de usar las moléculas de ARN para inhibir la
replicación viral:
- inhibición en sentido contrario.
- inhibición de los cuerpos enzimáticos - ribozimas -
- producción de señuelos ARN
desde que el genoma HDV contiene un ribozima, una aproximación interesante podría ser
el de modificar el ribozima del virus de tal modo que podría específicamente hacer
blanco en otras especies de ARN virales. (ejemplo ARN del HBV)
Finalmente, debe recalcarse que el loci específico para la actividad ARN de edición
del HDV, puede ser potencialmente un recurso valioso, en términos de desarrollar nuevos
caminos para la correción de los defectos genéticos humanos. Puede, específicamente ser
posible convertir las transcripciones del ARNm en un blanco, para corregir las
mutaciones equivocadas ó defectuosas de genes clave. (como el receptor transmembrana de
la fibrosis quística).
Evidencia experimental de aspectos clave de la biología
molecular del HDV
Dos experimentos clave se presentan a continuación:
En el primero, moléculas ARN del HDV fueron radio-marcadas en los terminales 5´ y
entonces se expusieron a un álkali, (hidrólisis alcalina parcial) para generar una
escalera de fragmentos marcados de ARN de varios tamaños. Se activó entonces el ribozima
ARN del HDV añadiendo iones de Mg++ (los iones de Mg++ son un cofactor necesario
para el ribozima). El resultado fué una partición del ARN en el loci de autolisis, (los
fragmentos má pequeños de ARN permanecieron intactos poruqe no tenían un loci de lisis)
y se pudo hacer un mapa por electroforésis en gel y autoradiografía de los fragmentos
ARN radioactivos.
El segundo experimento, el ARN del HDV fué sintetizado in vitro e incubado en la
presencia de la dsRAD purificada (dsARN adenosin-deaminasa). El ARN fué transcrito a la
inversa, amplificado con el PCR (para generar ADN bicatenario) y se sometió a una
restricción de la digestión enzimática. La edición del ARN por el dsRAD resultó en la
producción de nuevos loci restrictivos. (ccUAG -> ccaUGG [StyI]).
[ Atrás ] [ Principal ] [ Arriba ] [ Siguiente ]
Actualizado el 1/97, Steve Dewhurst, Associate Professor of Microbiology
and Immunology
© Copyright University of Rochester and Stephen Dewhurst, October 1996
URL: http://www.urmc.rochester.edu/smd/mbi/grad2/hdv97.html
|