Herpesvirus 1Steve Dewhurst, Associate Professor of Microbiology and
Immunology, University of Rochester Medical Center USA.
|
|
|
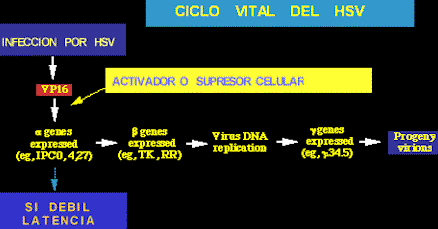
El HSV-1 codifica 75 proteínas, de las cuales solamente 37 son necesarias para el crecimiento viral en los cultivos celulares. estos genes esenciales codifican productos como : proteínas estructurales virales, proteínas requeridas para que el virus entre en las células diana, proteínas necesarias para la expresión viarl y proteínas necesarias para la replicación del genoma y de su enpaquetamiento. Los restantes genes virales no son necesarios en los cultivos celulares, pero (presumiblemente) tienen importantes funciones en el huésped infectado, entre las cuales pueden incluirse el afinamiento de la expresión viral y el sobreponerse a la respuesta del huésped a la infección.
Latencia de los Herpesvirus. El HSV-1 entra en los nervios sensitivos que inervan las membranas mucosas (como los labios), y puede establecer un estado de infección latente en éstas células. Se caracteriza por la presencia continua del genoma viral, en la ausencia de expresión viral. Por consiguiente, en el caso del HSV-1, no se requieren funciones virales codificadas para estabelcer un estado latente (aunque un conjunto completo de genes virales son necesarios para reactivarlos del estado latente, fenómeno que ocurre periódicamente en una parte de las neuronas que albergan HSV-1 latente). La biología molecular de la latencia del HSV-1 no está bien dilucidada. Solamente un único promotor viral parece permanecer activo durante la latencia, y este conduce a la expresión de especies no codificadoras de de ARN, designadas con el nombre de transcripciones asociadas a la latencia. LATs (latency-associated transcripts). La función del LATs sigue siendo poco conocida.
Otros alfa-herpesvirus (HSV-2, VZV) posiblemente se comportan de modo similar al HSV-1. Aunque los beta y gamma herpesvirus parecen tener diferentes estrategias para el establecimiento y mantenimiento de la latencia. Entre estos virus, probablemente el más estudiado es el virus de Epstein-Barr, el cual produce una infección latente en las células B. Como las células B son mitóticas, a diferencia de las neuronas, no es sorprendente que la infección latente del EBV sea considerablemente diferente y más complejas que las infecciones latentes por HSV-1.
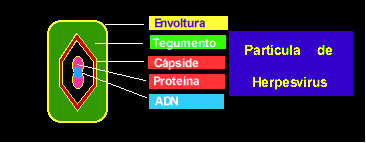
Genomas de los Herpesvirus
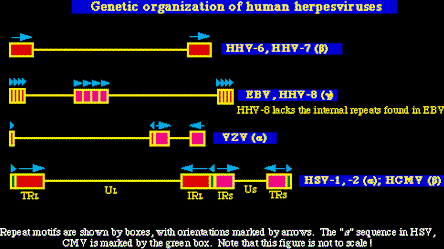
Los genomas de los herpesvirus comparten importantes propiedades. 1- todos los herpesvirus tienen una región única larga, usulamente de un tamaño de 100 kb, la cual codifica cerca de 100 genes. 2-Los herpesvirus tienen un número de elementos de repetición, internos y terminales. El tamaño y número de estos elementos de repetición varía. Apuntar que en el caso del HSV-1, HSV-2, VZV y HCMV, hay de hecho dos bloques de secuencias únicas, designadas Ul (Unique long = Unica larga) y Us (Unique Short = Unica corta), cada una de las cuales está unida por repetidores terminales, en cambio HHV-6, HHV-7, HHV-8 y EBV hay solamente una región única.
|
|
Replicación del ADN de los herpesvirus. Aunque las partículas de los herpesvirus contienen ADN linear, este ADN se vuelve rápidamente circular en las células infectadas, por mecanismos todavía desconocidos. Se cree que es ésta forma circular del genoma la que forma el substrato para la replicación del ADN viral.
La evidencia más reciente indica que la replicación del ADN de los herpesvirus está separada en dos fases distintas, y que puede proseguir en un modo bastante parecido al ADN del Bacteriófago T4. En particular, la fase inicial de la replicación del herpesvirus ocurre en orígenes específicos de la replicación de la fase lítica, mientras la replicación del ADN tardío ocurre por mecanismos dependientes de la recombinación, en la que la síntesis del ADN se hace por medio del genoma viral.
En todos los herpesvirus, con la excepción aparente del CMV, el origen sirve como un sitio específico de unión para una proteína esencial, codificada por el virus, proteína que se cree (19 distorsiona ó abre la doble hélice del ADN en este sitio, y (2) dirige la maquinaria de replicación del ADN viral (polimerasa, helicasa y otras proteínas) a este sitio. En los alfa-herpesvirus, y en los HHV-6 y HHV-7, se conoce a ésta proteína como la proteína de unión en origen (OBP :origin binding protein) y su única función es la unión en origen. En el EBV, se conoce a ésta proteína como Zta, y funciona al mismo tiempo como activador transcripcional y como proteína de unión-en-origen.
Al poco tiempo de que la replicación del ADN ha empezado, ocurre un cambio en el modo de la replicación. Es probablemente el resultado de una invasión de cadena, es un proceso por el cual una cadena de un pedazo de bases de ADN se empareja con una secuencia complementaria de un segundo pedazo de ADN. Este proceso es mediado por una recombinación homóloga. Su resultado es la formación de una molécula ramificada de ADN; la repetición de estos fenómenos es la formación de una estructura compleja no linear que tiene muchas ramas. (Uno se puede imaginar esta estructura como la de un árbol). Estas moléculas complejas, muy ramificadas de ADN, han sido demostradas en las células infectadas por el HSV-1, y se ha demostrado que una endonucleasa codificada por el virus es necesaria para la de-ramificación de las moléculas de este árbol de ADN, para que puedan ser empaquetadas en partículas virales.
|
|
Replicación del genoma durante la latencia. Algo sorprendente, neuronas infectadas en fase de latencia por el HSV-1, contienen un promedio de 10 ó mas genomas virales por célula. esto sugiere: (1) cada célula es infectada por varios virus, ó (2) el ADN del HSV-1 es replicado por la maquinaria celular durante el período de latencia. Los datos experimentales afianzan la segunda conclusión, y Roizman y sus colegas ha mostrado que el genoma del HSV-1 contiene un origen dependiente de la replicación del ADN del huésped (por ejemplo: un origen que puede utilizar la polimerasa ADN de la célula).
La fase latente de la replicación ADN de los herpesvirus es, como siempre, mejor entendida en los EBV. El EBV infecta de modo latente las células B, las cuales se dividen (a diferencia de las neuronas) y el EBV se encuentra con el problema que su genoma se diluirá y eventualmente desaparecerá, durante la división de las células B. Entonces el EBV ha desarrollado un mecanismo eficiente para asegurar que su genoma se replica durante la latencia. Este mecanismo depende en un origen de replicación latente específico y dependiente del virus HBV.
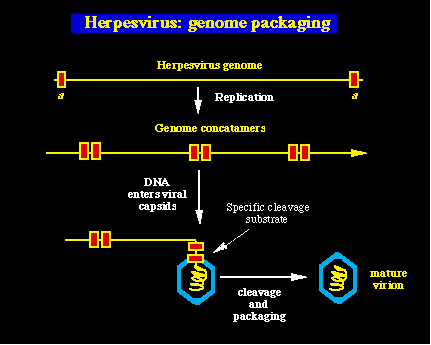
Enpaquetamiento del genoma. Ya que la replicación
produce cabeza-cola concatámeros, el ADN de los herpesvirus debe ser partido a unidades
de longitud antes de ser enpaquetado en partículas virales. Este proceso es mediado por
partición endonucleolítica, específica de lugar, del ADN viral replicado en la unión
entre los genomas individuales. La manera en que esto funciona es que hay estructuras
especializadas localizadas en los finales de los genomas de los herpesvirus (se conocen
como secuencias a en el HSV-1, y
contienen proteínas de consenso de secuencias, conocidas como
pac-1 y pac-2,
y se hallan cerca del terminal del genoma de todos los herpesvirus). Cuando estas
secuencias se juntan, se genera una partición endonucleolítica específica.
Nota: existe un nivel adicional de complejidad en el HSV-1, HSV-2, y el HCMV. Estos virus contienen una secuencia interna, localizada entre los segmentos del genoma Ul y el Us. Lo que significa que la partición puede ocurrir internamente, y por ende que los componentes L y S de los genomas de estos virus pueden nvertirse entre si, produciendo, cuatro isómeros lineares del genoma en igual frecuencia. La isomerización del genoma también ocurre en el VZV, pero con frecuencias desiguales. (Ul casi siempre ocurre con una sola orientación).
Brote y ensamblaje de los herpesvirus: Los herpesvirus
brotan en la membrana nuclear interna y dspués entran al citoplasma. Son típicamente
liberados por medio del retículo endoplasmático. Casi todos los herpesvirus matan la
célula huésped durante la infección productiva, a excepción del citomegalovirus, el
cual crece lentamente e induce un efecto citopático, de ese efecto deriva su nombre,
(células citomegálicas, con un citoplasma abundante y muchas inclusiones
intra-nucleares). Note que el CMV no paraliza los
procesos metabólicos celulares, al contrario que los demás herpesvirus. En cambio,
estimula la síntesis de las proteínas celulares, ARN y ADN.
|
|
Evolution de los herpesvirus:
Los herpesvirus infectan todas las especies vertebradas conocidas, y se piensa que son muy antiguas (cientos de millones de años de existencia, ó más). Al considerar la evolución de los herpesvirus, es importante considerar la naturaleza de las mutaciones que le han dado una ventaja selectiva de crecimiento. Básicamente, hay dos tipos de estas mutaciones, Bonhoeffer and Nowak, PNAS 91:8062, 1994). La primera, hay mutaciones egoístas, las cuales le confieren una ventaja dentro del huésped y operan a nivel del virus como individuo único y su única y particular célula huésped. Estas mutaciones le dan a un virus, en cualquier huésped, una ventaja en la competencia con otros virus. Segundo: Hay mutaciones altruístas, que son neutrales respecto a una competencia dentro del huésped. estas mutaciones operan para dar una ventaja a toda la población viral; por ejemplo alterando la respuesta inmune del huésped a la infección viral. Los herpesvirus son un buen ejemplo de que los virus han evolucionado usando estrategias altruístas, ya que ha adquirido muchos genes que operan de modo altruísta; por ejemplo, genes que ayudan a estos virus a evadir la respuesta inmunitaria del huésped.
Lista de genes seleccionados comprometidos en la evasión de las respuestas inmunitarias del huésped.
Ref.: Lewin, D.I. J. NIH Res. 7:49-53, Sept. 1995
Patogenia de las infecciones por los herpesvirus
Los puntos clave de los herpesvirus son: ubicuos (están en todas partes, se encuentran en todos los grupos humanos, en todo el mundo), la infección primaria generalmente, ocurre de modo subclínico en la niñez, y subsecuente persistencia viral durante toda la vida. Los herpesvirus no ubicuos son HSV-2 y el HSV-8, los cuales se transmiten por relaciones sexuales con personas contaminadas.
En cualquier momento después de la infección inicial, puede aparecer una reactivación. La infección suele ser localizada y es más frecuente en personas estresadas, ancianas ó inmunocomprometidas. En este último grupo, pueden aparecer reactivaciones generalizadas, que pueden ser severas y aún poner en peligro la vida.
Potencial oncogénico de los herpesvirus: los herpesvirus gamma, notablemente el EBV y el HHV8 han sido asociados con una variedad de tumores.
Control de las infecciones por los herpesvirus: Solamente está aprobada una sola vacuna para los herpesvirus para su uso en humanos. Es la vacuna de la varicela para el VZV, la cual está hecha con virus vivos y atenuados, y es 70-90% efectiva; aprobada por la FDA en 1995. Las vacunas para otros herpesvirus están en desarrollo, incluyendo las vacunas contra el HCMV, HSV-1, HSV-2, y EBV
Fármacos antivirales: que pueden bloquear la replicación de los herpesvirus, incluyen los análogos de los nucleótidos de cadena terminal, aciclovir y ganciclovir (ambos son análogos de la guanina) y fármacos más recientes como el famciclovir (similar al aciclovir) y cidofovir, el cual es es el primer análogodel nucleótido (ejemplo: monofosfato del análogo del nucleótido) para uso clínico.
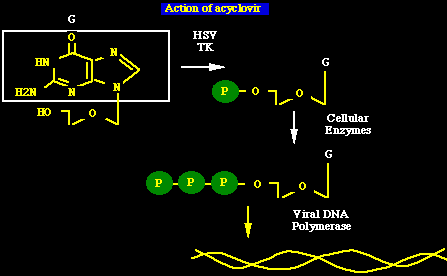
Mecanismo de acción del aciclovir: el aciclovir necesita la timidina cinasa (TK) del HSV ó del VZV para una fosforilización inicial eficiente. Después, el monofosfato es convertido en trifosfato de aciclovir (ACV-TP) por las cinasas celulares. El ACV-TP es incorporado en el ADN viral por la polimerasa viral, la cual utiliza el ACV-TP de modo más eficiente que la polimerasa de la célula. La base incorporada previene la elongación de la cadena, pues carece de la ribosa que tendría la molécula normal. Así, la especifidad del aciclovir se determina a dos niveles: fosforilización inicial y la incorporación al ADN.
El Ganciclovir es más tóxico que el aciclovir, pero actúa de modo similar. es más efectivo en contra del citomegalovirus (el cual carece del gen TK). Ganciclovir parece que es inicialmente fosforilado por el producto génico UL97 del CMV (una cinasa viral, también se encuentra en el HHV-6), y es convertido a trifosfato de Ganciclovir por enzimas celulares. Ambos fármacos: aciclovir y ganciclovir, presentan el problema de que los virus pueden convertirse en resistentes a los fármacos, debido a mutaciones en la polimerasa ADN viral ó en las cinasas (TK ó UL97). Cidofovir es mejor respecto al ganciclovir, ya que no requiere la fosforilación por el UL97. (ya está fosforilado).
Nuevos fármacos están en desarrollo, incluyendo bloqueantes peptídicos de la reductasa ribonucleótida viral y también como bloquenates de la proteasa de maduración del CMV. (Análoga a la proteasa del HIV).
|
Bioquímica del aciclovir |
|
|
Aplicación de los herpesvirus: vectores para la terapia génica. Los HSV pueden ser usados como vehículos de transporte de genes. Se pueden hacer dos tipos básicos de vectores. Los primeros son vectores muy defectuosos que requieren un virus colaborador para replicar y empaquetar su ADN. estos vectores se conocen como amplicones (amplicons), y contienen las secuencias mínimas cis-activas del ADN del HSV necesarias para la replicación y enpaquetamiento del genoma (por ejemplo: el origen más la secuencia a ). El segundo tipo de vehículo es un vector de reemplazamiento génico. estos son, usualmente, genomas intactos de HSV en los cuales se ha reemplazado un único gen por otro de nuestro interés. El gen seleccionado para ser reemplazado es frecuentemente el gen TK, ya que no es esencial para el crecimiento viral en los cultivos de tejidos, pero produce una atenuación viral in vivo, (lo que significa que el vector es probable que sea seguro).
La mayor ventaja de usar a los herpesvirus como vectores es su habilidad para entregar genes exógenos a neuronas post-mitóticas y expresar los genes por un período largo de tiempo. ventajas adicionales de estos vectores son: 1- no se integran en los cromosomas del huésped.(a diferencia de los retrovirus), 2-se replican con títulos altos in vitro (>= 100 millones de partículas por ml) y 3-en teoría, pueden albergar grandes injertos de ADN (por encima de 30 kb).
Patogenia y relevancia médica de los herpesvirus:
Virus del Herpes Simplex 1 y 2: Los virus HSV-1 y HSV-2 son descamados de las lesiones activas, ó descamarse durante las recidivas asintomáticas. El HSV-1 es ubicuo y causa lesiones en la piel y en las mucosas del ojo y de la boca, y también queratoconjuntivitis y encefalitis. Pueden ocurrir infecciones intrauterinas, neonatales y post-natales, una secuela común es la encefalitis, la cual afecta a 1 de cada 3 bebés infectados, con un pronóstico malo. El HSV-2 es la causa de la mayoría de los casos de herpes genital (HSV-1 = 10-15%, el cual es menos severo ), e infecta aproximadamente al 20% de los adultos estaudinenses. La prevalencia del HSV-2 está en alza, y pueden producirse infecciones neonatales muy severas.
Después de la infección inicial, persisten los HSV-1 y HSV-2. Penetran en las terminaciones nerviosas sensitivas y migran a través de los axones hasta los ganglios paravertebrales. El HSV-1 infecta la mucosa oral y viaja hasta el ganglio del trigémino. El HSV-2 infecta la mucosa genital y viaja hasta los ganglios sacros. (Nota: este modo de transmisión no es absoluto y se han descrito infecciones oral-genital ). las infecciones HSV recidivan en respuesta a estímulos como la luz solar intensa, estrés, frío, rsfriados,catarros, ó inmunosupresión. estas recidivas son habitualmente localizadas, pero pueden generalizarse si el huésped tiene una alteración de su sistema inmunitario. Nota: cerca del 1% de todas las personas infectadas por el HSV-2 experimentan reactivaciones.
Virus del Varicela-Zóster. Varicella Zoster virus (VZV).. VZV es un alfa herpesvirus. se propaga por vía respiratoria y la infección prmaria se da principalmente en niños, donde la enfermedad puede ser asintomática ó manifestarse como Varicela, que es una enfermedad eruptiva, vesiculosa, con fiebre no muy alta. El virus establece un estado latente en los ganglios nerviosos sensoriales de la columna ó de los nervios craneales, y puede ser reactivado por la edad, hormonas (embarazo) ó por inmunosupresión. La recidiva se manifiesta por el Herpes Zóster, el cual puede ser doloroso (neuralgias) y puede ser severo.
Herpesvirus humanos. HHV-6, HHV-7: Son
beta-herpesvirus, realmente primitivos en términos genéticos y comparten propiedades
importantes con los HSV-1. Pero no codifican la timidina cinasa y por eso no son afectados
por el aciclovir.
HHV-6 es un virus pan-linfotrópico que infecta a varios tipos de células inmunitarias, incluyendo las células T y las asesinas naturales (NK), también a células del sistema nervioso central (como lo hace el HSV-1) El HHV-7 es interesante porque usa el receptor CD4 como componente de su receptor. Ambos virus han demostrado su potencial lítico in vitro , y crecen lentamente (como lo hace el CMV). Las características genéticas de éstos virus incluyen: 1-la presencia de una proteína repetidora telomérica ([TTAGGG]N) cerca del terminal del genoma de ambos: HHV-6 y HHV-7, y 2-la presencia de un homólogo del gen del virus rep en HHV-6 asociado a la adenosina.
El HHV-6 ha sido relacionado con enfermedades febriles, como la roseóla (exantema súbitum ) en los niños, y HHV-7 puede causar algunos casos de reseóla y también de Pitiriasis rosea. Ambos virus ya han infectado a más del 90% de los niños a la edad de 3 años, y persiste durante toda la vida. Se ha sugerido que el HHV-6 tiene un protagonismo en el síndrome del cansancio crónico ó de la esclerosis múltiple, aunque hay escasos datos que apoyen estos supuestos. El HHV-6 es un patógeno muy importante en las personas inmunocomprometidas, donde puede causar neumonía; y en los recipientes de transplantes, donde puede ocasionar el fallo de la médula ósea.
Citomegalovirus humano (CMV). Es un beta-herpesvirus y su genoma codifica genes cuya función es regular a la baja la respuesta inmune antiviral. Incluyen productos génicos con las siguientes funciones:
- Inhibición de la expresión celular de clase I MHC (US2, US3, US11)
- Inhibición de la función del trsnportador asociado con la presentación del antígeno (TAP) (UL18)
- Inhibición de las células asesinas naturales (NK) (UL18)
- Embargo ó secuestro de las citocinas (US28)
CMV también codifica proteínas que pueden incentivar la síntesis celular de macromoléculas. Incluyen tres homólogos de los receptores acoplados de la proteína G (GCR = G protein Coupled Receptors). Además, el producto IE2 (aka IE84) del CMV une la proteína p53 en las células musculares lisas, y puede ser importante en la proliferación celular en la ateroesclerosis y en la estenosis de la cicatriz que ocurre en un tercio de las operaciones de angioplastia coronaria.
El CMV se propaga por la vía respiratoria, y aproximadamente mas del 85% de la población mayor de 35 años es positiva al CMV. Es una causa importante de infecciones neonatales ó congénitas y pueden ser muy severas en el 5-10% de los casos, esto se debe a su habilidad para cruzar la placenta. Se reactiva de la misma manera que los demás herpesvirus y puede producir retinitis y/o neumonía en individuos inmunosuprimidos. Debido a que el virus no tiene el gen TK, las infecciones de CMV son tratadas con Ganciclovir.
EBV, HHV8: Vea las notas sobre los herpesvirus en la Lección 2
Actualizado en 1/99, Steve Dewhurst, Associate Professor of Microbiology
and Immunology
© Copyright University of Rochester and Stephen Dewhurst, 1996-99
URL: http://www.urmc.rochester.edu/smd/mbi/grad2/herp99A.html