Patogénesis, Lentivirus /VIHSteve Dewhurst, Associate Professor of Microbiology and
Immunology, University of Rochester Medical Center USA.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades de los lentivirus de los primates. | ||||
| Gpo | VIRUS | Abbrv | Huésped natural | Enfermedad |
| A | Virus de la inmuno-deficiencia humana tipo I | VIH-1 | Humano | SIDA, inmunodeficiencia, caquexia, encefalitis, neumonía |
| Virus de la inmunodeficiencia de los simios, cpz | SIVcpz | Chimpancé | Ninguna | |
| B | Virus de la inmuno-deficiencia humana tipo 2 | VIH-1 | Humano | SIDA, inmunodeficiencia, caquexia, encefalitis, neumonía |
| Virus de la inmunodeficiencia de los simios , smm/mac | SIVsmm/mac | Mangabey | Ninguna | |
| C | Virus de la inmunodeficiencia de los simios, agm | SIVagm | Mono verde africano | Ninguna |
| D | Virus de la inmunodeficiencia de los simios, mnd | SIVmnd | Mandril | Ninguna |
| E | Virus de la inmunodeficiencia de los simios, syk | SIVsyk | Mono de Sykes | Ninguna |
Propiedades de los lentivirus que afectan a los que no son primates |
|||
| VIRUS | Abbrv | Huésped natural | Enfermedad |
| Virus Visna-Maedi | VMV | Ovejas | Caquexia, neumonía, encefalitis, artritis |
| Virus de la inmunodeficiencia bovina | BIV | Vacas | Ninguna |
| Virus de la inmunodeficiencia felina | FIV | Gatos | Caquexia, neumonía, encefalitis |
| Virus de la anemia equina infecciosa | EIAV | Caballos | Anemia y caquexia |
| Virus de la Encefalitis-artritis caprina | CAEV | Cabras | Encefalitis, artritis. |
Resumen
- Virus de la inmunodeficiencia humana tipe 1 (VIH-1) y el virus de la inmunodeficiencia de los chimpancés (SIVcpz)
- VIH, tipe 2 (VIH-2) y SIV de los mangabeys y macacos (SIVsmm/mac)
- SIV de los monos verdes africanos (SIVagm)
- SIV de los mandriles (SIVmnd)
- SIV de los monos de Sykes (SIVsyk)
Todos los lentivirus están relacionados genéticamente entre sí, mucho más que los oncovirus, y todos tienen estructuras genéticas similares: gag/pol/env más los genes accesorios (trans activadores).
El prototipo de los lentivirus son virus que producen las infecciones lentas de las ovejas. Estos virus fueron descritos por primera vz en 1950 por Bjorn Sigurdsson, quien estudió al maedi/visna, una infección progresiva de las ovejas de Islandia.
La Maedi/Visna es una enfermedad compleja con neumonía y encefalitis, tiene un tiempo de incubación de aproximadamente 2 años. Es causada por un solo virus que se propaga en los adultos por vía respiratoria y a los corderos por la leche. Maedi es una palabra Islandesa que significa "respiración trabajosa", y se refiere a la neumonía que padecen los animales afectados. Es la forma más común de la enfermedad. Visna es otra palabra Islandesa para definir "parálisis y caquexia" y se refiere a la degeneración progresiva del SNC de los animales afectados, que termina con déficit motor y con parálisis.
Mirados como un grupo, los lentivirus tienen muchas propiedades comunes que ayudan mucho a entender al VIH.
En términos de su biología y de su composición genética, las propiedades principales de los lentivirus son:
- Los lentivirus pueden infectar a las células que no se dividen. Al contrario que los oncoretrovirus, los lentivirus pueden infectar de modo eficiente las células diferenciadas como los macrófagos. Macrófagos residente en tejidos, como los macrófagos del cerebro (ó microglia) pueden desempeñar un papel importante para el desarrollo de aspectos específicos de las enfermedades inducidas por virus.
- Los genomas de los lentivirus codifican proteínas
regulatorias. Además de las proteínas estructurales (gag, env) y de las
proteínas enzimáticas (pol), que también se encuentran en los
oncoretrovirus, los
lentivirus también codifican proteínas regulatorias. La más notables de éstas
proteínas son las parecidas al Tat y al Rev, las cuales regulan respectivamente, la transcripción viral y el
transporte del RNA viral.
En término de su patogenésis, las propiedades más importantes son:
- Los lentivirus persisten durante toda la vida. Es una función que nace tanto de su habilidad para integrarse en los cromosomas del huésped como la de evadir la inmunidad del huésped. La propiedad para evadir la inmunidad del huésped está relacionada tanto con el alto grado de mutación de estos virus como de su poder para infectar a las células del sistema inmune (macrófagos, y en el caso del VIH, las células T).
- Los lentivirus tienen un alto grado de mutación. Los lentivirus se replican, mutan y son seleccionados por la respuesta inmunitaria del huésped.
- Hay una variación en la presentación de la enfermedad. La enfermedad puede presentarse en forma de tumores ó de otras infecciones (debido a la inmunodeficiencia inducida por el virus) como la encefalitis, caquexia, neumonía y artritis. En muchos casos, las lesiones son producidas como resultado de la inmunopatología (por ejemplo, Maedi es el resultado de la infiltración linfocítica de los pulmones y Visna es el resultado de la respuesta inmunitaria que ataca los oligodendrocitos infectados).
- Hay una variación en el tiempo, en cuanto al inicio de la
enfermedad. Varios cofactores influyen en el tiempo que debe pasar antes
de que aparezca la enfermedad, entre otros:
- La historia genética del huésped (algunas cepas de ovejas, como es el caso de las ovejas de Islandia, son más susceptibles al virus Visna-Maedi.
- La edad del huésped (entre más jóvenes, mayor susceptibilidad y rapidez en la aparición de la enfermedad).
- El estrés (la enfermedad recidiva con más frecuencia en los caballos previamente infectados con el virus de la anemia equina infecciosa).
- Factores virales (la virulencia del virus es variable de una cepa viral a otra).
- Las infecciones tienen al menos 3 etapas:
- Inicial: (aguda), la infección por lentivirus está asociada con una replicación y diseminación viral muy rápida, acompañada a veces por una patología transitoria.
- Establecimiento (latencia), etapa en la cual el virus es controlado por el sistema inmune y no hay indicios de enfermedad.
- Tardía. después de un cierto tiempo empieza una etapa de alta replicación viral, y se produce la enfermedad.
|
|
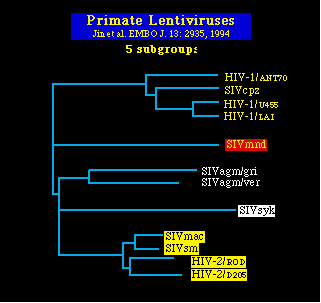
Lentivirus de los primates
Recuerde que existen 5 subgrupos de lentivirus de
los primates:
VIH-1/SIVcpz; SIVmnd; SIVagm; SIVsyk;
VIH-2/SIVsm
Descubrimiento de los lentivirus humanos
- SIDA (AIDS) fué reconocida como una nueva enfermedad en 1981, con el informe de 5 casos de neumonía por Pneumocystis carinii (PCP) en 5 hombres que previamente estaban sanos, en el área de los Angeles (USA). En ese tiempo, el tener un solo caso de PCP constituía una rareza y el hecho de tener un conjunto de 5 casos, apuntaba a que algo nuevo y extraño estaba empezando.
- En 1983, Francoise Barre-Sinoussi, Claude Chermann , Luc Montagnier del Instituto Pasteur aislaron un retrovirus de las células de un nódulo linfático de un paciente con linfoadenopatías y lo llamaron: virus asociado a linfoadenopatía (LAV = lymphadenopathy-associated virus). Al año siguiente, el grupo de Robert Gallo del NIH confirmaron y ampliaron este hallazgo, relacionándolo con el síndrome de inmunodeficiencia adquirida, SIDA (AIDS).
- En 1986, un segundo VIH fué aislado en el Africa Occidental (VIH-2).
Origen de los lentivirus humanos
Estudios filogenéticos de los lentivirus de los primates han aportado pruebas evidentes de que el VIH-1 está muy relacionado con el virus que de modo natural infecta a los chipamcés (SIVcpz), mientras que el VIH-2 está más relacionado con el virus que infecta a los monos mangabey (SIVsmm). Se cree que ha habido una transferencia de los virus que producen inmunodeficiencia, de los monos a los humanos, con el resultado de la infección emergente del VIH-1 y VIH-2, un argumento reforzado por el hecho de que los monos tiznados mangabey residen en la misma región en que la infección por VIH-2 es más prevalente.
No solo es posible de que los virus VIH-1 y VIH-2 han evolucionado de los lentivirus de los simios, sino de que también hay evidencia de otras transferencias aisladas de simios a monos, que han dado lugar a cepas genéticamente distantes de VIH-1. Por ejemplo, el subgrupo O del VIH-1 (O = Outgroup, fuera del grupo), son diferentes de todas las demás cepas de VIH-1, y se cree que han derivado de un diferente ancestro. Por lo que el VIH-1 y VIH-2 se pueden calificar como infecciones emergentes.
VIH-2
De los dos virus asociados con el SIDA, el VIH-1 está distribuido por todo el mundo, mientras que el VIH-2 permanece bastante restringido al África Occidental.. La propagación de ambos virus parecen seguir las mismas rutas (principalmente por transmisión sexual y también por sangre y fluidos corporales infectados). Esta conferencia se centrará sobre el VIH-1, aunque es importante conocer algunas características del VIH-2 :
- No hay pandemia de VIH-2, o sea que no hay una epidemia global de VIH-2. La infección está restringida al África Occidental (Camerún, Costa de Marfil, y Senegal). Lo que sugiere que el VIH-2 no se transmite tan eficientemente como el VIH-1, y seguimos sin saber por qué.
- El VIH-2 es menos patogénico que el VIH-1. Las personas infectadas con el VIH-2 permanecen mucho más tiempo asintomáticas antes de desarrollar la enfermedad.
- Hay evidencia de que las personas infectadas con el VIH-2 pueden tener un riesgo menor para adquirir el VIH-1. Lo que sugiere que la infección previa por VIH-2 puede proteger contra la infección por VIH-1. Este hallazgo tiene importantes implicaciones para el diseño de las vacunas contra el VIH-1, posiblemente basadas en cepas atenuadas ó debilitadas del VIH-1.
Epidemiología de la infección VIH-1
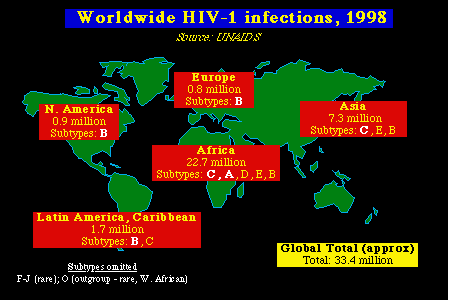
La epidemia global (pandemia) de la infección por VIH-1 está creciendo con mucha rapidez en las naciones del Sur-Este de Asia y en el subcontinente de la India, aunque el mayor número de personas infectadas sigue estando en el África sub-sahariana. Datos recientes (1998), dan un total de 33 millones de adultos y niños infectados por VIH-1 en todo el mundo. Asimismo en todo el mundo, la infección afecta de modo desproporcionado mucho más a las minorías y a los pobres.
|
|
Distribución global del VIH-1.
Los subtipos del VIH-1 se encuentran en regiones específicas del mundo, se puede ver como
el subtipo B predomina en las Américas y en Europa, mientras que el subtipo C es más
frecuente en el resto del mundo. En África, el subtipo A es el segundo en
prevalencia. Lo
que sale a la luz es de que las epidemias regionales se producen por virus
genéticamente distintos, lo que puede tener implicaciones en las campañas de
vacunación. Por ejemplo, no está claro que las vacunas desarrolladas a partir de cepas
VIH-1 subtipo B sean las idóneas para aplicarlas en el África sub-sahariana, donde los
subtipos predominantes son los C y los A.
Patogénesis de la infección VIH
Características clínicas de la infección VIH
Como las demás infecciones por lentivirus, la infección por VIH-1 puede dividirse en diferentes etapas:
- Síndrome de la infección aguda primaria. La infección primaria por el VIH-1 puede ser asintomática, ó puede asociarse con con una enfermedad muy parecida a la gripe, con fiebre, malestar general, diarrea y fenómenos neurológicos como dolor de cabeza. Suele durar de 2-3 semanas y la recuperación es total.
- Infección asintomática. Es el estado de portador asintomático que sigue a la infección inicial. Típicamente tarda muchos años, con una disminución paulatina en el número de células T CD4+ circulantes. En una minoría de casos, la infección no va más allá de esta fase y el recuento de células T CD4+ permanece estable (a estas personas se las conoce como supervivientes a largo plazo, ó no progresivos a largo plazo.)
- Infección sintomática y SIDA. Los síntomas relacionados con la infección por
VIH-1 comienzan a
aparecer. El SIDA suele aparecer habitualmente entre los 10-12 años después de la
infección inicial y se define por la aparición de enfermedades más serias y por una
disminición en el recuento de las células T CD4+ por debajo de 200 / microlitro. NOTA:
los esfuerzos futuros para definir mejor los parámetros de la progresión de la
enfermedad se basarán posiblemente en analizar la
carga viral (copias de RNA viral por
microlitro de plasma) en lugar de los recuentos de células T CD4+. Los ejemplos de las
infecciones indicativas de SIDA, incluyen:
- Infecciones: neumonía por Pneumocystic carinii , Tuberculosis, Candidiasis esofágica, Toxoplasmosis cerebral, retinitis por CMV.
- Cánceres: cáncer cervical, sarcoma de Kaposi, varios linfomas de células B relacionados con el EBV
- Encefalopatía ligada al VIH, caquexia ligada al VIH y neumonía intersticial linfoide (niños).
|
|
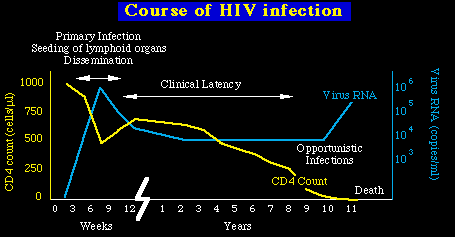
Patogénesis de la infección viral
- Infección primaria: Una vez que la persona se ha infectado por el VIH-1, aparece una infección primaria aguda que dura unas pocas semanas y se caracteriza por una clínica parecida a la gripe. Esta infección primaria representa el primer encuentro del sistema inmune con el VIH-1. Mientras el sistema inmune aprende a controlar el VIH-1, el virus es capaz de replicarse a niveles muy altos durante muchas semanas. Así en la sangre se pueden hallar niveles altos del virus. La replicación viral disminuye las células T CD4+ significativamente.
- Fase asintomática: Después de pocas semanas, se desarrolla una respuesta inmune específica contra el VIH-1 y la replicación viral se reduce bastante, y así disminuyendo la carga viral y casi normalizando el recuento de las células T CD4+. A continuación se establece un equilibrio (a niveles altos) en la replicación viral que continúa incesante. Se ha estimado que en esta etapa de la infección, se producen cerca de 10 billones de partículas virales y de que cerca de un billón de linfocitos T CD$+ son destruídos cada día.(Perelson et al. Science 271:1582, 1996).
- SIDA: eventualmente, el recuento de células T CD4+ cae por debajo del dintel compatible con una función inmune efectiva y la enfermedad progresa rápidamente, culminando en la muerte del individuo.
Un modelo de patogenésis
El estado de alto dinamismo de la replicación del VIH-1, puede durar más de 10 años, en cuyo tiempo el cuerpo reemplaza activamente las células T destruídas continuamente. Este requerimiento constante de reemplazar los billones de células T destruidas, se cree, que gradualmente agotan la habilidad del organismo para reproducir éstas células.
NOTA: Hay teorías alternativas para explicar la patogénesis del SIDA, entre ellas la idea de que la continua evolución del genoma del VIH-1 eventualmente supera la habilidad del sistema inmunitario para responder ("sobrecarga inmune", propuesta por Martin Nowak y otros). Eric Pelletier y Simon Wain-Hobson han anotado de que " podría ser un error, tal vez un poco perverso, insistir en que algún cambio genético en el VIH-1 es necesario para la aparición del SIDA, descontando el efecto de 5 a 15 años de persistente replicación viral".(J. NIH Res. 8:45, Sept. 1996).
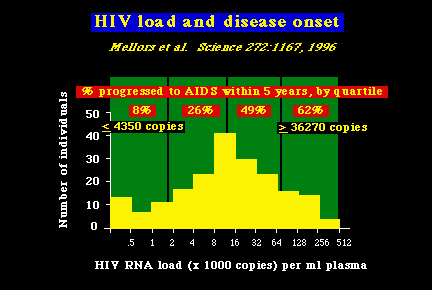 |
Una carga viral alta está asociada con una rápida progresión de la enfermedad. Como podía esperarse, según el modelo de la patogénesis del VIH-1, los niveles altos de la replicación del VIH-1 (cargas virales altas) están asociados con un mayor rapidez de la progresión de la enfermedad, como se muestra en el gráfico.
Mellors y sus colaboradores midieron la cantidad de RNA del VIH-1 en el plasma de grandes grupos de personas asintomáticas infectadas por el VIH. Después ellos las agruparon en 4 grupos basados en la cantidad de copias virales que tenían en la sangre, y estudiaron la progresión al SIDA de estas personas. Encontraron que el 62% de las personas con altas cargas virales (>36,270 copias) desarrollaron SIDA en los siguientes 5 años, mientras que solamente el 8% de las personas que tenían cargas virales bajas (< 4,350 copias) desarrollaron el SIDA en ese mismo período.
Supervivientes a largo plazo: A pesar de lo que le ocurre a la mayoría de las pesonas que son infectadas por el VIH1, hay un número significativo de personas infectadas por VIH-1 quienes nunca enfermarán, ni experimentarán una disminución en el recuento de las células T CD4+ y nunca presentarán cargas virales altas. Estos supervivientes a largo plazo son el 5% de todas las personas infectadas por VIH-1. La razón de por qué nunca desarrollan la enfermedad, no se sabe con seguridad, pero pueden incluir factores del huésped y factores virales, como puede ser la infección por cepas atenuadas de modo natural (ejemplo: virus con la secuencia Nef borrada).
Diversidad viral: la enorme diversidad genética del VIH-1 puede ser atribuída a una extensión sin precedentes en la replicación viral, y a la natural tendencia al error que existe en la replicación. Se ha estimado que el promedio del tiempo de generación de VIH in vivo (definido como el tiempo que pasa entre la liberación de la partícula viral hasta que infecta a una célula y produce una nueva generación de partículas virales) es de 2.6 días Perelson et al. Science 271:1582, 1996). Lo que significa que el VIH-1 se replica a una frecuencia de 140 ciclos por año, generando nuevas y continuas mutaciones
|
|
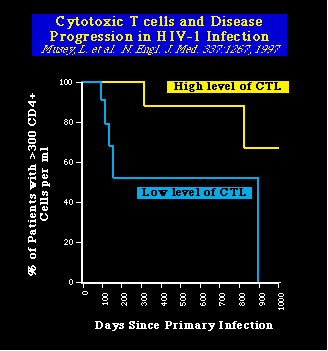
Importancia de la inmunidad antiviral
Las respuestas inmunes antivirales y las células T citotóxicas antígeno específicas (CTL) en particular, han sido consideradas desde hace tiempo como elementos críticos para el control de la fase inicial de la replicación viral y del resultado final de la persona infectada. Consistente con estas ideas, un estudio hecho por Musey y colaboradores, encontraron que un nivel alto de CTL como respuesta del ataque inicial por el VIH-1 se correlacionaba muy bien con una disminución en la progresión de la enfermedad, definida por una caída en el recuento de las células T CD4+.
Dinámica viral de la infección por VIH-1
Una de las áreas que ha tenido un mayor crecimiento en el conocimiento de la enfermedad en los último años, es nuestra comprensión de la dinámica de la infección del VIH-1. Ha sido posible gracias al desarrollo de métodos más sensibles para la medición directa de las copias de RNA VIH-1 en la sangre y en los tejidos y también por la disponibilidad de fármacos antiretrovirales, los cuales esencialmente le permiten a uno detener completamente una nueva infección viral, al menos por un tiempo. Así, uno puede medir la rapidez en la caída del nivel viral en el tiempo, una situación en la que el único virus que se produzca tiene que venir de un reservorio que ya existía cuando se aplicó el tratamiento antiviral.
Análisis de alta sensibilidad para detectar el RNA viral. Los análisis cuantitativos incluyen:
- Amplificación de la reacción en cadena de la polimerasa (PCR) de la transcriptasa inversa (RT), (RT-PCR). este análisis puede ser cuantitativo por medio del uso de controles internos. RT-PCR es posiblemente el procedimiento más usado para cuantificar el RNA viral.
- El análisis del DNA ramificado (bDNA). este procedimiento no implica la amplificación de los ácidos nucleicos, en su lugar usa un método muy sensitivo para probar la presencia de RNA viral, usando una sonda marcada muy ramificada de DNA.
- Amplificación de los ácidos nucleicos basada en su secuencia (NASBA = Nucleic acid
sequence-based amplification ). Este método usa la amplificación del RNA del
VIH utilizando una polimerasa RNA bacteriana, en combinación con la transcriptasa inversa.
Fase estable de la replicación viral y conjunto de celular infectado. Tal y como se explicó antes, la replicación del VIH-1 durante la fase asintomática de la infección se caracteriza por estabilización a un nivel alto de replicación. En este momento, una consideración importante es el tamaño y la composición del conjunto de todas las células infectadas.
En una persona normal, no infectada, en un momento dado, la mayoría de las células T se encuentran en estado de reposo, en una proporción equivalente de células en reposo y de células de memoria. En la persona infectada con VIH-1, la proporción de células T activadas sube, aunque siguen siendo una minoría. A continuación se ve en la tabla (Chun et al. Nature 387:183, 1997; Wain-Hobson, S. Nature 387:123, 1997) la proporción de células T CD4+ que están infectadas con el VIH-1 en un momento dado:
| Conjunto celular | Número de células |
| Linfocitos totales del cuerpo | 1012 célula |
|
células CD4+ T que contienen VIH DNA (sin integrar) |
aprox. 0.5% (~109 células) |
| células CD4+ que contienen integrado y latente el VIH DNA | aprox. 0.05% (~108 células) |
| células CD4+ T productoras activas de virus
|
aprox. 0.005% (<107 células) |
Lo más importante de este trabajo es el hecho de que el número
total de células que son productoras activas del VIH-1 es bastante bajo (<107
células), éstas células producen aprox. 103-104
viriones cada una. El tamaño tan pequeño del reservorio viral activo, es
esperanzador desde el punto de vista terapéutico, pero hay que señalar que existe un subconjunto considerablemente mayor de células infectadas de
modo latente, las cuales son capaces de producir virus después de una
estimulación adecuada. Este subconjunto celular es una causa de de preocupación, ya que
estas células no son afectadas por los fármacos antivirales actuales. Las
preguntas que surgen son: ¿ Cuánto viven las células infectadas por VIH-1 ?
¿Hay un reservorio (de células infectadas) de larga duración en el cuerpo ?
Para responder estas preguntas, los investigadores han examinado la cinética de la disminución viral en aquellas personas que han recibido tratamientos muy activos anti-retrovirales (HAART), para el tratamiento de la infección del VIH-1. (HAART = Highly Active Anti-Retroviral Therapy; es el uso de múltiples fármacos usados en combinación y típicamente se compone de 3 fármacos donde al menos uno de ellos es un inhibidor de la proteasa y otro es un inhibidor de la transcriptasa inversa).
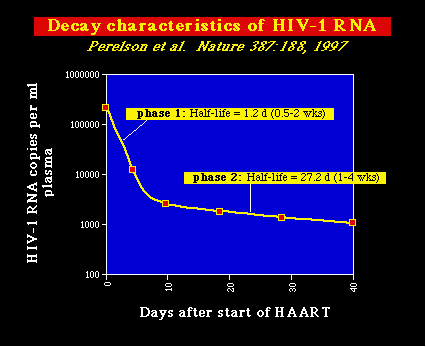 |
Cinética de la disminución de la carga viral: Su
estudio en las personas que están recibiendo HAART han revelado la existencia de al
menos dos fases distintas de este proceso:
- Durante la primera fase, la cual se completa de modo habitual dentro de las dos semanas siguientes a la iniciación de HAART, la carga viral cae por un factor de 100. Las características de esta fase inicial, sugiere que el subconjunto de células T CD4+ activamente infectadas es de corta duración, y su eliminación conduce por lo tanto a una caída rápida de la carga viral.
- Durante la segunda fase, la carga viral sigue disminuyendo lentamente en el tiempo. Esta disminución más lenta, refleja la producción de vius desde un subconjunto de células infectadas que tiene una vida media más larga. Se ha sugerido, que puede ser debido a la producción viral por los macrófagos infectados, los cuales tienen una vida media, en los cultivos celulares, más larga que las células T infectadas.
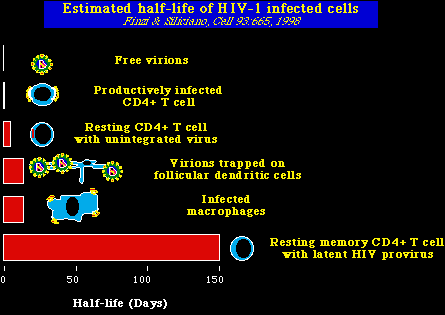 |
¿Existe
un tercer reservorio de células infectadas por VIH-1 ? Basado en las estimaciones
predecibles de la vida media, del segundo subconjunto celular de células
productoras de viriones, se deduce que el tratamiento de
HAART debería continuarse en 2-3 años para eliminar completamente al VIH-1 del cuerpo.
Esta afirmación se basa en el supuesto de que no existe otro reservorio que pueda
replicar el virus.
En el momento presente, no se sabe si existe un tercer reservorio. Se ha dicho que las células de memoria T CD4+ , algunas de las cuales pueden albergar a un provirus latente de VIH-1, tienen una larguísima vida media, de algo más de 22 semanas. Este dato tiene serias implicaciones respecto al tiempo necesario para mantener el tratamiento de HAART en las personas infectadas por el VIH-1, pues sugiere que puede existir un reservorio muy estable de virus que pueden reactivar la infección si el tratamiento fuera suspendido demasiado pronto.
NOTA: Las células dendríticas
foliculares (FDC), son células especializadas dentro de los tejidos linfáticos, atrapan
los antígenos y los presentan a las células inmunitarias circulantes.También pueden
atrapar partículas VIH-1 infecciosas.
Vacunas
"Hace 36 años que el Presidente Kennedy miró al cielo y proclamó que la bandera de la paz y de la democracia, no la de la guerra ó la de la tiranía, debe ser la primera bandera puesta en la luna, él nos dió una meta para llegar a la luna, y lo conseguimos antes del tiempo previsto..."
"Vamos hoy a sentar una nueva meta nacional para la ciencia en la era de la biología. Hoy, vamos a comprometernos todos nosotros en desarrollar una vacuna contra el SIDA dentro de la próxima década...Si América se propone encontrar una vacuna contra el SIDA y enrolamos a otros en nuestra causa, lo conseguiremos. Estoy preparado para hacer todo lo que sea necesaria para ello." Presidente Bill Clinton, May 18th 1997
La meta actual de los esfuerzos para obtener la vacuna es prevenir la infección VIH-1 El Presidente Clinton ha comprometido a los Estados Unidos para desarrollar dicha vacuna para el año 2007.
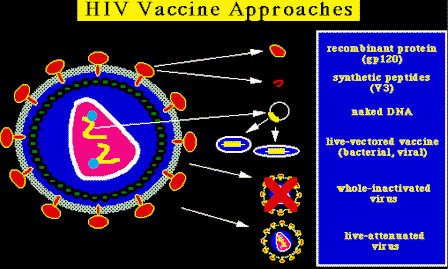
Los esfuerzos actuales para obtener la vacuna, incluyen:
- Proteínas recombinantes, producidas en el E.Coli, en las levaduras ó en las células de los mamíferos. Posiblemente la más estudiada es la proteína recombinante soluble gp120, producida por las células de los mamíferos. La proteína soluble es razonablemente buena para desencadenar una buena respuesta inmunitaria, pero da pobres resultados para generar una respuesta de las células T.
- Vacunas DNA. Vectores de expresión de DNA recombinante purificado que codifican proteínas VIH-1. Se pueden poner en la piel por medio de una pistola génica (la cual coloca perlas de DNA recubiertas de oro a una alta velocidad), ó por medio de una inyección intramuscular ó subcutánea. Dichas vacunas parecen bastante buenas para producir una respuesta de células T pero muy mala en inducir la producción de anticuerpos.
- Vacunas que usan vectores vivos (bacterias ó virus). estas vacunas son capaces de expresar los antígenos recombinantes VIH-1 dentro de las células infectadas. Ejemplos de vectores ya probados, incluyen el virus vaccinia ó el "canarypox", los cuales expresan los genes del VIH-1. Nuestro nuevo vector es el virus de la encefalitis equina de Venezuela (VEE), el cual tiene la propiedad de infectar las células dendríticas (es el mayor grupo celular del cuerpo que presenta los antígenos a las células inmunitarias circulantes). Típicamente, las vacunas que usan vectores vivos son buenas para estimular la respuesta de las células T, pero muy malas en inducir la producción de anticuerpos.
Cada una de las estrategias descritas están siendo ensayadas en humanos y algunos de
éstos experimentos han entrado en la fase II de los ensayos clínicos, lo que significa
que se están haciendo pruebas a pequeña escala en las poblaciones de alto riesgo,
para determinar si son efectivas para prevenir la infección del VIH-1. Si se obtienen
resultados prometedores, será necesario hacer los ensayos clínicos a escalas más
grandes, (Fase IV).
Tal vez los candidatos más prometedores para obtener la vacuna, sean los ensayos
combinando los diferentes esfuerzos. Uno podría ser: usar una vacuna DNA para
"fijar" la respuesta inmune, seguido de una vacuna que use un vector viral
(vaccinia) para amplificar la respuesta. Otras estrategias en este sentido están siendo
evaluadas actualmente.
|
|
Una estrategia de alto riesgo para el desarrollo de una vacuna contra el VIH-1 es el uso
del virus VIH-1 vivo y atenuado.
Como lo hemos discutido en otra conferencia,
se han identificado varios métodos genéticos para atenuar el VIH-1. Entre éstos
métodos está el de borrar múltiples genes virales que no son necesarios para la
replicación in vitro, pero que
influyen en la inducción de la enfermedad in vivo
(como son: nef, vpr, vpu). La
preocupación de éste método es que dicha vacuna pueda algún día producir
enfermedad. Si, por desgracia, las demás estrategias fracasan, puede ser necesario
reconsiderar este tipo de vacuna, teniendo en cuenta que la gran mayoría de vacunas
actualmente en uso, se hacen con virus vivos y atenuados.
Actualizado el 1/99, Steve Dewhurst, Associate Professor of
Microbiology and Immunology
© Copyright University of Rochester and Stephen Dewhurst, 1996-99
URL: http://www.urmc.rochester.edu/smd/mbi/grad2/VHI99A.html