Inhibidores de la proteasa y SIDABarra de exploración
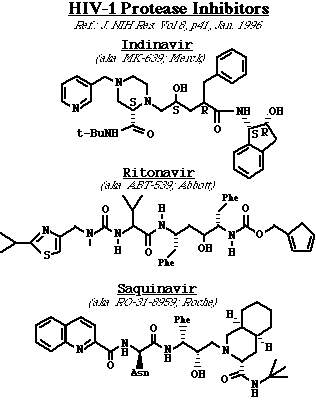
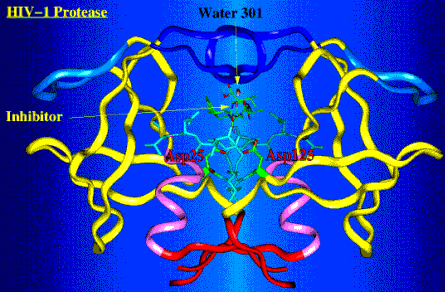
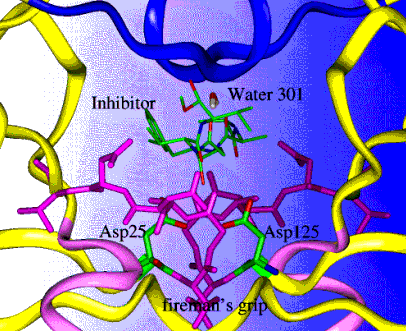
Proteasa del HIV: (HIV PR) es un homodímero C2 simétrico. Nomenclatura: usualmente se numera al primer monómero como 1-99 y al segundo 101-199, 301 designa a la molécula de agua (por convención de los estudios cristalográficos). La HIV PR contiene residuos de ácido aspártico apareados, se localizan en el "suelo" del sitio activo del enzima (Asp25, Asp125 [algunas veces denominados como Asp25']). Además, el complejo enzima-substrato también contiene una molécula muy importante de agua en su estructura (designada como "water 301" en las imágenes), la cual está interpuesta entre el substrato y las zonas flexibles del enzima (el agua contacta los residuos Ile50 y Ile150 [algunas veces designados como Ile50']).del HIV PR. esta molécula de agua es única en las proteasas retrovirales comparadas a otras proteasas de ácido aspártico. Por eso algunos de los inhibidores de las proteasas buscan a ésta molécula de agua. Entre éstos inhibidores están los grupos químicos que imitan las propiedades de la unión hidrógeno de la molécula de agua, y la excluyen del sitio activo del enzima. Inhibidores de la HIV PR: La mayoría de los inhibidores enzimáticos son compuestos que imitan a los péptidos que son análogos de estados de transición. En otras palabras, dichos compuestos imitan la configuración del estado transicional del substrato natural del HIV PR Como consecuencia, los inhibidores se unen al enzima más fuertemente que el substrato natural (ya que el substrato debe distorsionarse para asumir la configuración de estado de transición). Estos compuestos son por lo tanto, inhibidores enzimáticos competitivos, y se clasifican de acuerdo a la simetría de sus estructuras. Así, el inhibidor de Merck, Indinavir y el inhibidor de Roche, saquinavir son asimétricos, mientras que el ritonavir de Abbot es muy simétrico. Problemas: la disponibilidad oral de las drogas ha sido un gran problema desde su desarrollo (en muchos casos, el 5% ó menos de la droga ingerida llega al torrente sanguíneo). Además,en muchos casos la habilidad de estas drogas de atravesar la barrera hemato-encefálica es muy limitada. Para mayor información, véase Erickson and Wlodawer, Annu. Rev. Biochem. 62:543-585, 1993. ImágenesSe muestran el HIV-1 PR formando un complejo con su inhibidor. Explicación de los esquemas:
Noticia importante: Todas las imágenes que se muestran aquí, se reproducen con el amable permiso de su autor:, Dr. Jiri Vondrasek of NCI (National Cancer Institute) (vond@proxima.ncifcrf.gov). La página www del Dr. Vondrasek's WWW puede verse pulsando aquí
imagen aumentada de la anterior Púrpura: Residuos 26-30, los cuales forman uniones potentes, llamados agarrón de bombero, se ve solamente en ésta imagen Actualizado el 3/98, Steve Dewhurst, Associate Professor of
Microbiology and Immunology URL: http://www.urmc.rochester.edu/smd/mbi/med/hivpr.html |